题目内容
下列离子反应方程式错误的是( )
分析:A.铁离子水解生成胶体;
B.电解生成氢氧化铝沉淀、氢气、氯气;
C.发生氧化还原反应生成硫酸钠和盐酸;
D.只有-COOH与NaHCO3溶液反应.
B.电解生成氢氧化铝沉淀、氢气、氯气;
C.发生氧化还原反应生成硫酸钠和盐酸;
D.只有-COOH与NaHCO3溶液反应.
解答:解:A.25mL沸水中逐滴加入1mL FeCl3饱和溶液的离子反应为Fe3++3H2O
Fe(OH)3(胶体)+3H+,故A正确;
B.用石墨电极电解饱和AlCl3溶液的离子反应为2Al3++6Cl-+6H2O
3C12↑+3H2↑+2Al(OH)3↓,故B错误;
C.少量SO2气体通入次氯酸钠溶液中的离子反应为ClO-+SO2+H2O=2H++Cl-+SO42-,故C错误;
D.水杨酸(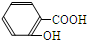 )与足量的NaHCO3溶液混合的离子反应为
)与足量的NaHCO3溶液混合的离子反应为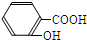 +HCO3-→
+HCO3-→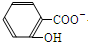 +CO2↑+H2O,故D正确;
+CO2↑+H2O,故D正确;
故选BC.
| ||
B.用石墨电极电解饱和AlCl3溶液的离子反应为2Al3++6Cl-+6H2O
| ||
C.少量SO2气体通入次氯酸钠溶液中的离子反应为ClO-+SO2+H2O=2H++Cl-+SO42-,故C错误;
D.水杨酸(
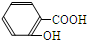 )与足量的NaHCO3溶液混合的离子反应为
)与足量的NaHCO3溶液混合的离子反应为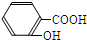 +HCO3-→
+HCO3-→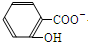 +CO2↑+H2O,故D正确;
+CO2↑+H2O,故D正确;故选BC.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意选项BC为解答的易错点,题目难度不大.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
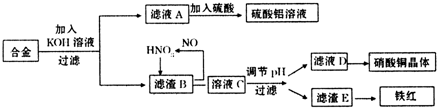
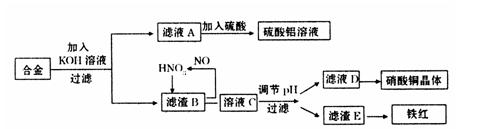
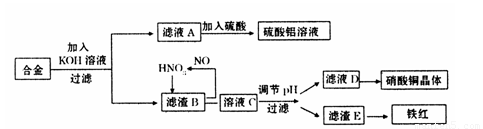
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下: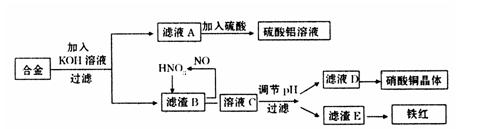
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
。
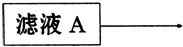
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)
(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是 (填序号)
| A.铜粉 | B.氨水 | C.氧化铜 | D.氢氧化铜 |
(填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1。将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是 ,被还原的n(HNO3)= 。