��Ŀ����
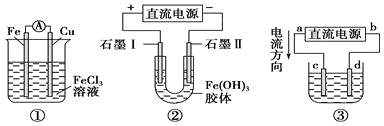
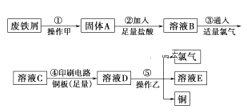
����Ŀ��ijУ̽����ѧϰС�����Ѳ�������ķ���м����ӡˢ��·��ĸ�ʴ����������ͭ��̽���������£�
��ش��������⣺
��1����������ȼ����ȵ�Na2CO3��Һ�����ۣ�������������_____��
��2��������У���������ӦFe��2HCl=FeCl2��H2���⣬�������ܷ�Ӧ�����ӷ���ʽΪFe2O3��6H��=2Fe3����3H2O��____��
��3����ҺC����ɫ��____����ҺD�п��ܺ��еĽ�����������___��
��4��������֤��ҺB���Ƿ���Fe2����һ���Լ���____(��ѡ�����)��
a��ϡ���� b���� c�����軯�� d�����Ը��������Һ
��5�������ҵ�������___������ݲ�������ͭ�Ļ�ѧ����ʽΪ____��
���𰸡����� Fe+2Fe3+=3Fe2+ �ػ�ɫ Fe2+��Cu2+��Fe3+ d ��� CuCl2![]() Cu+Cl2����
Cu+Cl2����
��������
����м���ټ����ȵ�Na2CO3��Һ�����ۣ��������˲����ɵõ�����A���������ᣬ����Fe2O3+6H+=2Fe3++3H2O��Fe+2Fe3+=3Fe2+Ȼ��ͨ������������������2Fe2++Cl2=2Fe3++2Cl-����ҺCΪFeCl3�����ڸ�ʴӡˢ��·������Cu+2Fe3+=2Fe2++Cu2+ͨ���������ҿɵõ�������ͭ��E����������������������������ͭ�����õ��Ȼ�������Һ��
(1)����м���ټ����ȵ�Na2CO3��Һ�����ۣ��ɵõ�����A��Ӧ�������˲������ʴ�Ϊ�����ˣ�
(2)��������������֪������AΪFe2O3��Fe�Ļ����,�������ᷢ��Fe2O3+6H+=2Fe3++3H2O��Fe+2Fe3+=3Fe2+���ʴ�Ϊ��Fe+2Fe3+=3Fe2+��
(3) ��������������֪����ҺB ΪFeCl2�� FeCl3�Ļ���ͨ������������������2Fe2++Cl2=2Fe3++2Cl-��������ҺCΪFeCl3�����ػ�ɫ�����ڸ�ʴӡˢ��·�������ķ�ӦΪ��Cu+2Fe3+=2Fe2++Cu2+������ҺD�п��ܺ��еĽ�����������Fe2+��Cu2+��Fe3+���ʴ�Ϊ���ػ�ɫ��Fe2+��Cu2+��Fe3+��
(4)��ΪFe2+���л�ԭ�ԣ���ʹ���Ը��������ɫ�����������Ը��������Һ���飬�ʴ�Ϊ:d��
(5) ��������������֪����ҺD�к��е�����ΪFe2+��Cu2+��Fe3+��Cl-������ݲ�������ͭ�����������ⷴӦ�Ļ�ѧ����ʽΪ��CuCl2![]() Cu+Cl2�����ʴ�Ϊ����⣻CuCl2
Cu+Cl2�����ʴ�Ϊ����⣻CuCl2![]() Cu+Cl2����
Cu+Cl2����

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ�������̼�IJ����������ҹ���Դ�����һ����Ҫս�Է���
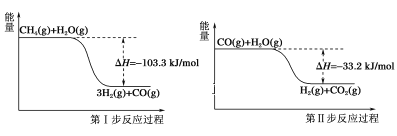
��1���û���̿��ԭ�����Դ�������β���еĵ������ij�о�С����ij�ܱ��������������Ļ���̿��һ������NO��������ӦC(s)+ 2NO(g) ![]() N2(g)+CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ���Ũ�����£�
N2(g)+CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ���Ũ�����£�
Ũ��/(mol/L)/\ʱ��/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
�ٸ���ͼ�����ݷ���T1��ʱ���÷�Ӧ��0��10min�ڵ�ƽ����Ӧ����v(N2)��____________mol��L-1��min-1������÷�Ӧ��ƽ�ⳣ��K��_____________��
����30min��ֻ�ı�ijһ���������ϱ��е������жϸı������������____________������ĸ��ţ���
A.������ʵĴ��� B.�ʵ���С���������
C.ͨ��һ������NO �� D.����һ�����Ļ���̿
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ2��3��3����ﵽ��ƽ��ʱNO��ת����___________������ߡ����͡�������H______0���>����<������
��2����ҵ����CO2��H2��Ӧ�ϳɶ����ѡ���֪��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H1��-49.1 kJ��mol��1
CH3OH(g)��H2O(g) ��H1��-49.1 kJ��mol��1
2CH3OH(g)![]() CH3OCH3(g)��H2O(g) ��H2��-24.5 kJ��mol��1
CH3OCH3(g)��H2O(g) ��H2��-24.5 kJ��mol��1
д��CO2(g)��H2(g)ת��ΪCH3OCH3(g)��H2O(g)���Ȼ�ѧ����ʽ_______________��
��3��������ȼ�ϵ�ؾ�������ת���ʸߡ���������ص�����㷺Ӧ�ã�һ�ֶ�����������أ������ΪKOH��Һ���ĸ�����ӦʽΪ��_________________________��
��4�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
����ij�β���õ�pH=10 ����Һ������Һ��c(CO32-)��c(HCO3-)=_______________��[������K1(H2CO3
������2LNa2CO3��Һ��4.66gBaSO4 ����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ__________________________��[��֪��������Ksp(BaSO4)=1��10-11��Ksp(BaCO3)=1��10-10]����������Һ����ı仯��
����Ŀ����һ�������·�����Ӧ��4NO2(g)��O2(g)![]() 2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
ʱ��/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol��L��1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol��L��1) | 1.00 | c1 | c2 | 0.50 |
��1��0��10s��N2O5��ƽ����Ӧ����Ϊ___�����¶��µ�ƽ�ⳣ��Ϊ___��
��2�������������䣬���������ѹ��һ�룬�����´ﵽƽ��ʱc(N2O5)___2.00mol��L��1���>��<��=������ͬ��
��3�������¶�T1ʱƽ�ⳣ��ΪK1���¶�T2ʱƽ�ⳣ��ΪK2����K1<K2����T1__T2��
��4���ı���Щ��ʩ��������NO2��ƽ��ת����___����������������ɣ�
��5����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJ��mol1
2C(s)+O2(g)=2CO(g) ��H=��221.0kJ��mol1
C(s)+O2(g)=CO2(g) ��H=��393.5kJ��mol1
������β�������ķ�Ӧ֮һ��2NO(g)+2CO(g)=N2(g)+2CO2(g)��H=___kJ/mol��
����Ŀ����֪��![]() ʱ
ʱ
��ѧʽ |
|
|
|
����ƽ�ⳣ�� |
|
|
|
����˵����ȷ���� ( )
A. ����ϡ�����У�![]() ��С
��С
B. ![]() ��Һ�У�
��Һ�У�![]()
C. ������HCN��Һ�м���![]() ,������
,������![]()
D. ���ʵ���Ũ����ͬʱ![]()
����Ŀ��ʵ�����Ʊ�1,2��������ķ�Ӧԭ�����£�CH3CH2OH![]() CH2=CH2����H2O��CH2=CH2��Br2��BrCH2CH2Br��������������������Ҵ��Ʊ�1,2���������װ������ͼ��ʾ��
CH2=CH2����H2O��CH2=CH2��Br2��BrCH2CH2Br��������������������Ҵ��Ʊ�1,2���������װ������ͼ��ʾ��
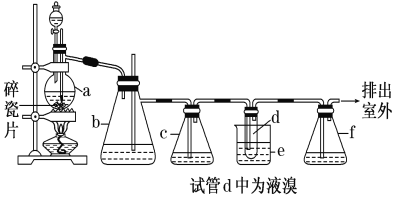
�й������б����£�
�Ҵ� | 1,2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g��cm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
�ش��������⣺
(1)��װ��c��Ӧ����________(ѡ�����)����Ŀ�������շ�Ӧ�п������ɵ��������塣
��ˮ ��Ũ���� ������������Һ �ܱ���̼��������Һ
(2)�ж�d�����Ʊ��������鷴Ӧ�ѽ������������________��
(3)����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��ˮ��________(��ϡ����¡�)�㡣
(4)��������������δ��Ӧ��Br2�������________(����ȷѡ��ǰ�����)ϴ�ӳ�ȥ����ˮ��������������Һ���۵⻯����Һ�����Ҵ�
��5����Ӧ������������ˮ��ȴ(װ��e)�� �����ñ�ˮ���й�����ȴ��ԭ��__________________��