题目内容
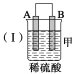
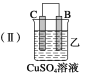
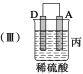
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:

(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是____________,其质量为____________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶_______∶________∶_________。
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”。下同)____________,H2SO4溶液的浓度____________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为______g。
【答案】(1)正 (2)Ag 2.16(3)2∶0.5∶1(4)不变 增大(5)45.18
【解析】
试题分析:(1)用惰性电极电解H2SO4溶液相当于电解水,观察图中c、d两电极上的小试管,根据气体产生的比例,可推断d电极生成的是H2,而c电极生成的是O2,所以M为电源的正极,N为电源的负极。
(2)由反应2H2O![]() 2H2↑+O2↑可知n(H2)∶n(O2)=2∶1,所以该电路中通过的电子物质的量为336 mL/22400 mL·mol-1×2/3×2=0.02 mol,b为Pt电极,也是电解池的阴极,0.02 mol Ag+得0.02 mol电子生成0.02 mol Ag,质量为0.02mol×108g/mol=2.16 g。
2H2↑+O2↑可知n(H2)∶n(O2)=2∶1,所以该电路中通过的电子物质的量为336 mL/22400 mL·mol-1×2/3×2=0.02 mol,b为Pt电极,也是电解池的阴极,0.02 mol Ag+得0.02 mol电子生成0.02 mol Ag,质量为0.02mol×108g/mol=2.16 g。
(3)电源输出的电子为0.02 mol,b电极生成的Ag为0.02 mol,c电极生成的O2为0.005 mol,d电极生成的H2为0.01 mol,所以四者的比值为2∶2∶0.5∶1。
(4)a电极作阳极,Ag不断溶解进入溶液,能保持AgNO3溶液相对稳定性,所以AgNO3溶液的浓度不变;而由于H2SO4溶液不断被电解,水量减少,使浓度增大。
(5)设原有5.00%的H2SO4溶液的质量为x。则:x×5.00%=(x-336 mL/22400mL·mol-1×2/3×18 g·mol-1)×5.02%,解得:x=45.18 g。