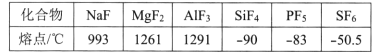
题目内容
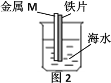
【题目】某兴趣小组用下图装置研究原电池的工作原理。

(1)甲中K断开时,装置中发生反应的离子方程式为_____________;K闭合时,Cu棒上的现象为__________,它为原电池的___(填“正”或“负”)极,电极反应式为_______,外电路电流的方向由___到______(填“Cu”或“Zn”)。
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的____填“正”或“负”)极,发生____(填“氧化”或“还原”)反应。
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式: _________________。
【答案】Zn+2H+=Zn2++H2↑ 有气泡产生 正 2H++2e=H2↑ Cu Zn 负 氧化 Fe-2e=Fe2+
【解析】
由装置分析可知,甲中K断开时,未构成原电池,Zn直接与稀硫酸反应生成氢气;K闭合时,构成原电池,Zn为负极;乙为氢氧燃料电池,燃料电池中通入氧气的极为正极,发生还原反应,据此分解结合原电池知识解答问题。
(1)甲中K断开时,未构成原电池,Zn直接与稀硫酸反应生成氢气,发生反应的离子方程式为Zn+2H+=Zn2++H2↑;K闭合时,构成原电池,Zn为负极,Zn失去电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,则Cu为正极,电极表面H+得到电子发生还原反应,电极反应式为2H++2e=H2↑,可观察到Cu棒上产生气泡,外电路电流方向由正极到负极,即由Cu到Zn,故答案为:Zn+2H+=Zn2++H2↑;有气泡产生;正;2H++2e=H2↑;Cu;Zn;
(2)燃料电池中通入氧气的极为正极,发生还原反应,则通入氢气的一极为电池的负极,发生氧化反应,故答案为:负;氧化;
(3)反应Fe+2FeCl3=3FeCl2中Fe发生氧化反应,应为原电池的负极材料,电解质溶液应选择FeCl3溶液,其中负极的电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+。