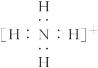题目内容
【题目】中国科学院成功开发出一种新型铝石墨双离子电池,大幅提升了电池的能量密度。该电池放电时的总反应为: AlLi+CxPF6![]() Al+xC+Li++PF6,有关该电池说法正确的是
Al+xC+Li++PF6,有关该电池说法正确的是
A. 充电时,PF6向阳极移动
B. 充电时,铝电极质量减少
C. 放电时,正极反应式为:Al+Li++e![]() AlLi
AlLi
D. 放电时,电子由石墨沿导线流向铝
【答案】A
【解析】
电池充电时的总反应化学方程式为Al+xC+Li++PF6-═AlLi+CxPF6,则放电时的总反应为AlLi+CxPF6=Al+xC+Li++PF6-,放电时AlLi被氧化,为原电池的负极,电极反应式为AlLi-e-=Al+Li+,正极CxPF6得电子被还原,电极反应式为CxPF6+e-=xC+PF6-,充电时,电极反应与放电时的反应相反。A、充电时,属于电解池的工作原理,PF6-向阳极移动,故A正确;B、充电时,属于电解池的工作原理,电解池的阴极发生得电子的还原反应,即Al+Li++e-=AlLi,所以铝电极质量增加,故B错误;C、放电时,属于原电池的工作原理,正极CxPF6得电子被还原,电极反应式为CxPF6+e-=xC+PF6-,故C错误; D、放电时,属于原电池的工作原理,电子由负极沿导线流向正极,即由铝沿导线流向石墨,故D错误;故选A。

 快乐暑假暑假能力自测中西书局系列答案
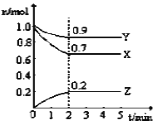
快乐暑假暑假能力自测中西书局系列答案【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
X | 其简单离子在第3周期元素的简单离子中半径最小 |
Y | 其最简单氢化物丙的水溶液呈碱性 |
Z | 原子核外电子数和周期序数相等 |
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种火箭发动机的高能燃料,一个分子中含有18个电子,其组成元素与丙相同,戊是两性氢氧化物。
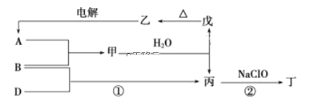
请回答:
(1)元素X在周期表中的位置是________,其简单离子的结构示意图为________。
(2)单质B电子式为________、丁电子式为________。
(3)丙中所包含的化学键类型有_______(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,1 mol NaClO参加反应时,转移2 mol电子,其离子方程式为______________。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。该化学方程式为____________________。