题目内容
一些常见化学反应可用下式表示 A + B → C+D+H2O 其中A为单质 (必要时可加热),请你根据下面的提示回答下列问题:
(1)若A、C、D均含有氯元素,则A与B溶液反应的离子方程式为: 。
(2)若C、D均为气体且有一种为红棕色,则B是 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B反应的化学方程式为: 。
如何稀释B的浓溶液 。
(4) 若A为紫红色的固体,D为无色无味的气体,则A与B溶液反应的离子方程式为: 。若产生标准状况下4.48L的D气体,则被还原的B的物质的量是 mol。
(1)Cl2+ 2OH-= Cl-+ ClO-+ H2O
(2)浓硝酸
(3)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 将浓硫酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌
CO2↑+2SO2↑+2H2O 将浓硫酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O 0.2
解析试题分析:(1)A、C、D均含有氯元素,可考虑氯气与强碱的反应,其离子方程式为Cl2+ 2OH-= Cl-+ ClO-+ H2O
(2)C、D均为气体且有一种为红棕色,则其中一种为二氧化氮,所以B为浓硝酸,反应为碳与浓硝酸共热的反应
(3)使澄清石灰水变浑浊的气体为二氧化碳、二氧化硫,所以该反应为碳与浓硫酸共热是反应,化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌
CO2↑+2SO2↑+2H2O;稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌
(4)A为紫红色的固体,A为铜,结合与铜反应产生无色无味的气体的事实,可判断该反应为铜与稀硝酸的反应,离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;标准状况下4.48L的NO的物质的量为0.2mol,则被还原的硝酸的物质的量也为0.2mol
考点:考查物质判断,氯气、硝酸、浓硫酸的化学性质,浓硫酸的稀释操作

 名校课堂系列答案
名校课堂系列答案现有四个无标签的试剂瓶,分别盛有硫酸、BaCl2溶液、盐酸和不知名称的某正盐溶液M,将四种试剂分别标为A、B、C、D,取少量试剂分别进行实验得到如表格所示关系(其中无色气体能使澄清石灰水变浑浊,M溶液进行焰色反应为黄色)。
| | A | B | C | D |
| A | | 白色沉淀X | | 白色沉淀Y |
| B | 白色沉淀X | | | 无色气体 |
(1)写出试剂名称:A ,B 。
(2)写出生成X的离子方程式: 。
(3)有人认为M是Na2CO3,此结论是否正确 (填“正确”或“不正确”),如认为正确,请说明推断的依据 ,如不正确,请说明理由 。
(4)若A、硝酸、D三种溶液混合后仍有沉淀,则其反应的离子方程式为 。
组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是 。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]= 。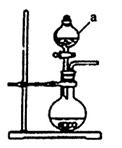
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。
①下列操作步骤的正确排序为 (填字母)。
| A.体系冷却后,停止通入Cl2 |
| B.通入干燥的Cl2赶尽装置中的空气 |
| C.在铁屑下方加热至反应完成 |
| D.用干燥的H2赶尽Cl2 |
②该实验装置存在的明显缺陷是 。
(3)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
已知:NaCl+3H2O
 NaClO3+3H2
NaClO3+3H2 ,
,2NaClO3+4HCl=2C1O2
 +Cl2
+Cl2 +2NaCl+2H2O。
+2NaCl+2H2O。有关物质性质:
| 物质 | 熔点/℃ | 沸点/℃ |
| C1O2 | -59 | 11 |
| Cl2 | -107 | -34.6 |
ClO2的生产流程示意图:
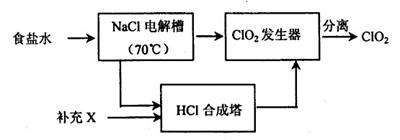
该工艺中,需要补充的物质X为 (填化学式),能参与循环的物质是 (填化学式)。从ClO2发生器中分离出ClO2可采用的方法是 。
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有 。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 ;SiHCl3极易水解,其完全水解的产物为 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)还原炉中发生的化学反应为: 。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
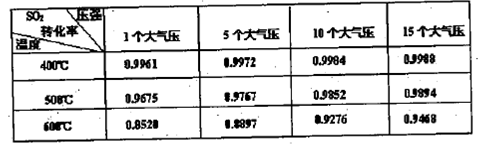
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
| n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O
 HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为: 。
(2)实验室用二氧化锰制取氯气的化学方程式为: ;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号)。
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为: ;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是 (选填下列选项的编号字母)。
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
①实验中产生的CO2气体质量为 ;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位) 。
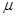 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 
 Ni(OH)2+M
Ni(OH)2+M