题目内容
【题目】图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
a 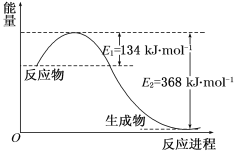 b
b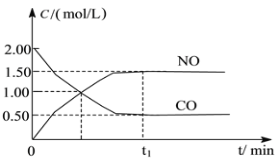
(1)写出NO2和CO反应的热化学方程式_______________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=__________。
(3)此温度下该反应的平衡常数K=_________;温度降低,K________(填“变大”、“变小”或“不变”)
【答案】NO2(g)+CO(g)=NO(g)+CO2(g) ΔH= —234 kJ/mol 1.50/t1 mol·L-1·min-1 9 变大
【解析】
(1)根据能量变化图,反应热等于生成物的总能量减去反应物的总能量,反应物和生成物能量的差值为E2-E1,写出化学方程式,标出各物质的状态,从而写出热化学方程式;
(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,根据v=![]() 计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);
计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);
(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大。
(1)该反应的焓变△H=E1-E2=134kJ/mol-368kJ/mol=-23kJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1。
(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,故v(NO)=1.5mol/L÷t1min=1.5/t1molL-1min-1,速率之比等于化学计量数之比,故v(NO2)=v(NO)=1.5/t1molL-1min-1,故答案为:1.5/t1molL-1min-1。
(3)CO的起始浓度为2mol/L,二氧化氮与NO的起始物质的量相等,故NO2的起始浓度为2mol/L,平衡时NO的浓度变化量为1.5mol/L,则:
NO2(g)+CO(g)=CO2(g)+NO(g)
开始(mol/L):2 2 0 0
变化(mol/L):1.5 1.5 1.5 1.5
平衡(mol/L):0.5 0.5 1.5 1.5
故该温度下平衡常数K=1.5×1.5/0.5×0.5=9,该反应正反应是放热反应,降低温度平衡向正反应方向移动,平衡常数变大,故答案为:9:变大。

 阅读快车系列答案
阅读快车系列答案【题目】下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
编号 | 化学反应 | 离子方程式 | 评价 |
| 碳酸钙与醋酸反应 |
| 错误,碳酸钙是弱电解质,不应写成离子形式 |
| 向 |
| 错误,碱过量,应生成 |
|
|
| 正确 |
| 等物质的量的 |
| 正确 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【题目】已知25 ℃时部分弱电解质的电离平衡常数如下表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a. CH3COOH b. H2CO3 c. NaHCO3 d. HClO
pH由小到大的排列顺序是____(填字母)。
(2)常温下,0.1 mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____(填字母)。
A. c(H+) B.![]() C. c(H+)·c(OH-) D.
C. c(H+)·c(OH-) D.![]() E.
E.![]()
(3)体积均为100 mL、pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是____。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况的体积大小关系为:CH3COOH____(填“大于”、“小于”或“等于”)HX