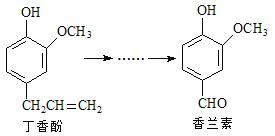
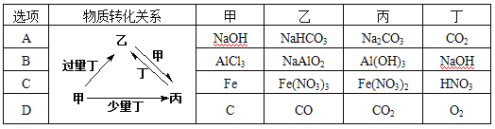
题目内容
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
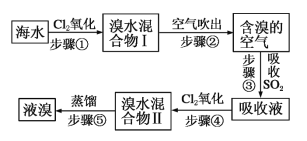
(1)步骤①反应的离子方程式是___________________。
(2)步骤③反应的化学方程式是___________________,从理论上考虑,下列也能吸收Br2的是___________________。
A.FeCl2 B.Na2SO3 C.H2O
(3)步骤①中已获得Br2,步骤③中又将Br2还原为Br-,步骤④又生成Br2,这样做的目的为___________________。
(4)已知海水中Br-含量为64mg/L,依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为___________________L(忽略Cl2的溶解)。
【答案】2Br-+Cl2=Br2+2Cl- SO2+Br2+2H2O=H2SO4+2HBr A、B 使Br元素得到富集 179.2
【解析】
海水中通入氯气氧化溴离子得到溴和水的混合物,用热空气吹出溴单质得到含有溴的空气,通过二氧化硫收集后富集溴元素得到吸收液,再通入氯气氧化溴化氢得到高浓度的溴水,蒸馏得到溴单质。
(1)海水中溴离子容易被氯气氧化为溴单质,氧化性氯气比溴强,反应的离子方程式为2Br-+Cl2=Br2+2Cl-;
(2)溴单质有氧化性,二氧化硫具有还原性,溴和二氧化硫在水溶液中易发生氧化还原反应,反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr;FeCl2溶液具有还原性,可以被溴单质氧化为FeCl3,可以吸收,A正确;Na2SO3溶液具有还原性,可以被溴单质氧化,可以吸收,B正确;水与溴单质反应微弱,不能充分吸收溴单质,C错误;故选择AB;
(3)海水中Br-的量少,被氯气氧化生成Br2,Br2的浓度很低,很难收集,如果直接溶于水,与水生成HBr和HBrO,而且这个反应还是可逆反应,反应程度不是很大,所以用少量的SO2和水汽与Br2反应可以更大程度吸收Br元素,这样等于是富集了溴;
(4)海水中Br-含量为64mg/L,则10m3的海水中含有640g Br-,通过反应2Br-+Cl2=Br2+2Cl-,可知640g Br-需要4mol的Cl2参加反应把海水中的Br-转化为Br2,随后SO2把溴单质还原为Br-,Br-还需要相同的反应变成Br2进行富集,故一共需要8mol的氯气参加反应,8mol氯气在标准状况下为179.2L。