题目内容
【题目】ClO2气体是安全、无毒的绿色消毒剂和保鲜剂,使用中不产生致癌物及二次污染物。某化学兴趣小组通过下图对其吸收、释放进行研究,请回答以下问题:
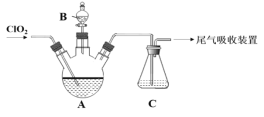
(1)用KClO3与Na2SO3在H2SO4酸化时制取ClO2,该反应的离子方程式为______。
(2)如图A中盛放有Na2CO3-H2O2混合溶液,常用于ClO2的吸收稳定剂。已知ClO2被稳定剂吸收生成NaClO2,若C中淀粉KI-H2SO4溶液变蓝,_____(填“能”或“不能”) 说明在仪器A中ClO2被完全吸收。
(3)已知ClO2的消毒能力是等物质的量Cl2的2.5倍,则ClO2在将含氰废液中的CN-氧化成CO2和N2的反应中,氧化剂和还原剂的物质的量之比为______。
(4)由B向A中滴加稀盐酸即可释放出ClO2,此时C的作用是_____。已知ClO2能被多种稳定剂所吸收,若将ClO2用于果蔬保鲜,图中吸收效果较好的稳定剂是___(填 “Ⅰ”或“Ⅱ”),原因是______。

(5)ClO2的“有效氯”可通过标定反应后溶液中的残氯[c(Cl-)]来测定。在分析化学中以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中的Cl-,当出现砖红色沉淀时,即指示达滴定终点。若保证溶液中c(Cl-)降为1.0×10-5 mol/L,则此时溶液中c(CrO42-)应不超过______mol/L。[Ksp(AgCl)=2.0×10-10,Ksp(Ag2CrO4)=2.0×10-12]。
【答案】2ClO3-+SO32-+2H+= 2ClO2↑+SO42-+H2O 不能 1∶1 检验是否有ClO2生成 Ⅱ 缓慢释放出ClO2,且能长时间维持保鲜所需要的浓度 5.0×10-3
【解析】
(1) KClO3具有氧化性,Na2SO3具有还原性,二者在酸性条件下发生氧化还原反应,KClO3被还原为ClO2,SO32-被氧化为SO42-,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为2ClO3-+SO32-+2H+= 2ClO2↑+SO42-+H2O;
(2)H2O2不稳定,分解产生的O2也可以将KI氧化产生I2,I2遇淀粉溶液会变为蓝色,所以说明在仪器A中ClO2被完全吸收;
(3)ClO2在将含氰废液中的CN-氧化成CO2和N2,它被还原为Cl-,反应的离子方程式为2CN-+2ClO2=2CO2↑+N2↑+2Cl-,可见氧化剂和还原剂的物质的量之比为1:1;
(4)A中ClO2被稳定剂吸收转化为NaClO2,由B向A中滴加稀盐酸即可释放出ClO2,此时C的作用是检验是否有ClO2生成;若将ClO2用于果蔬保鲜,要求稳定剂缓慢释放出ClO2气体,且能长时间维持保鲜所需要的浓度,这样保鲜期才可以延长,根据图示可知稳定剂II相对效果更好;
(5)c(Ag+)c(Cl-)> Ksp(AgCl)=2.0×10-10,c(Ag+)<2.0×10-10÷1.0×10-5=2.0×10-5mol/L,c2(Ag+) c(CrO42-)>Ksp(Ag2CrO4)=2.0×10-12,c(CrO42-)<2.0×10-12÷(2.0×10-5)2=5.0×10-3mol/L,即此时溶液中c(CrO42-)应不超过5.0×10-3mol/L。

 名校课堂系列答案
名校课堂系列答案



