��Ŀ����
��15�֣�̼���仯�����й㷺����;��
��1���ڵ绯ѧ�У�����̼���缫���ڼ���п�̸ɵ���У�̼���� ����
��2����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��C��s��+H2O��g��=CO��g��+H2��g������H=+131.3kJ?mol-1����Ҫ�Ʊ���״����22.4��ˮú����ת�Ƶĵ��ӵ����ʵ���Ϊ ����Ҫ���յ�����Ϊ kJ��
(3����ҵ�ϰ�ˮú���еĻ�����徭��������õĽϴ�H2���ںϳɰ���
N2��g����3H2��g�� 2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
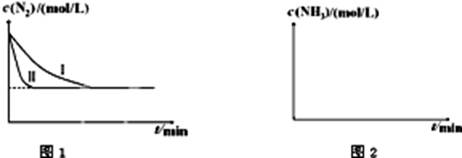
����ʵ���Ƚϣ�ʵ���ı������Ϊ�� ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
��4��Na2CO3���ڽ������������ŷ�������CO2�IJ�����1L0.2mol/L Na2CO3��Һ���ձ�״����2.24LCO2����Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
��1���ڵ绯ѧ�У�����̼���缫���ڼ���п�̸ɵ���У�̼���� ����
��2����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��C��s��+H2O��g��=CO��g��+H2��g������H=+131.3kJ?mol-1����Ҫ�Ʊ���״����22.4��ˮú����ת�Ƶĵ��ӵ����ʵ���Ϊ ����Ҫ���յ�����Ϊ kJ��
(3����ҵ�ϰ�ˮú���еĻ�����徭��������õĽϴ�H2���ںϳɰ���
N2��g����3H2��g��
 2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
����ʵ���Ƚϣ�ʵ���ı������Ϊ�� ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
��4��Na2CO3���ڽ������������ŷ�������CO2�IJ�����1L0.2mol/L Na2CO3��Һ���ձ�״����2.24LCO2����Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
��1������ ��2��1mol ��65.65KJ ��
��3����ʹ�ô��� �� ����4��C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) ��
����4��C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) ��
��3����ʹ�ô��� ��
 ����4��C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) ��
����4��C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) �������������1���ڵ绯ѧ�У�����̼���缫���ڼ���п�̸ɵ���У�̼����������ZnƤ����������2�����ݷ�Ӧ����ʽ��֪��ÿ����2mol��ˮú����ת�Ƶ���2mol������Ҫ�Ʊ���״����22.4��ˮú��������ȡ1mol���壬����ת�Ƶĵ��ӵ����ʵ���Ϊ1mol����Ҫ���յ�����Ϊ131.3KJ��2=65.65KJ����3������ʵ���Ƚϣ�ʵ���ﵽƽ������Ҫ��ʱ�����̣�����ƽ��ʱ���ʵ�Ũ��û�䣬��˸ı������Ϊ��ʹ�ô�������������������ͬ��ʵ����ʵ�����¶�Ҫ�ߣ����������¶ȣ���ѧ��Ӧ���ʼӿ죬���Դﵽƽ������Ҫ��ʱ�����̡��������ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����������¶ȣ�ƽ�������ƶ���N2��ƽ��Ũ������NH3��ƽ��Ũ�ȼ�С����ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼΪ��
 ��
����4��n(Na2CO3)= 1L��0.2mol/L=0.2mol��n(CO2)= 2.24L��22.4L/mol=0.1mol.����Һ�з�����Ӧ��Na2CO3+H2O+ CO2= 2NaHCO3�����ڶ��߷�Ӧʱ�����ʵ����ı�Ϊ1:1�����Է�Ӧ�����Һ��0.1mol��Na2CO3��0.2mol��NaHCO3��Na2CO3��NaHCO3����ǿ�������Σ�ˮ��ʹ��Һ�Լ��ԣ�C(OH-)>C(H+)�������ε�ˮ��̶������ģ�����C(CO32-)>C(OH-)��������Һ������Ũ�ȹ�ϵΪC(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) ��

��ϰ��ϵ�д�
�����Ŀ