题目内容
17.100mL6mol/L的硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液 ⑤CuSO4溶液.
| A. | ①②⑤ | B. | ①④ | C. | ②③ | D. | ③④⑤ |
分析 过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.
解答 解:①反应的实质为氢离子与锌的反应,硫酸钠固体不影响反应速率,故错误;
②加入水,体积增大,浓度减小,反应速率减小,生成氢气的量不变,故正确;
③加入硫酸钾溶液,不反应,由于体积变大,减小氢离子浓度但不改变其物质的量,反应速率减小,生成氢气的量不变,故正确;
④加入硝酸钾溶液,硝酸根离子在酸性条件下具有强氧化性,不生成氢气,故错误;
⑤加入CuSO4溶液,锌置换出铜,形成原电池反应,加快反应速率,故错误.
故选C.
点评 本题考查影响化学反应速率的因素,注意信息中Zn过量及浓度对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列叙述正确的是( )
| A. | 摩尔质量就等于该物质的相对分子质量或相对原子质量 | |
| B. | 硫酸的摩尔质量是98克 | |
| C. | 1molH2O的质量为18克 | |
| D. | 2molH2O的质量为18克 |
5.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3各0.01mol的混和溶液中,加入0.01mol的铁粉,经充分搅拌后,产生的变化是( )
| A. | 铁溶解,析出0.01molZn | |
| B. | 铁溶解,析出铜,且溶液中不含有Fe3+ | |
| C. | 铁溶解,析出0.01molCu | |
| D. | 铁溶解,溶液中金属阳离子只剩Fe2+和Zn2+ |
12.下列有关强、弱电解质的叙述正确的是( )
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
6.利用下述方法除去氮气中所含的杂质(HCl,H2,H2S)以得到干燥纯净氮气,在下列各步中应采用的正确顺序是( )
①通过装有变色硅胶的干燥管 ②通过氢氧化钠溶液 ③通过加热的氧化铜.
①通过装有变色硅胶的干燥管 ②通过氢氧化钠溶液 ③通过加热的氧化铜.
| A. | ①②③③ | B. | ②①③① | C. | ②③③① | D. | ③②①③ |
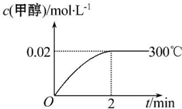 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0. 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.