题目内容
【题目】从工业含锌废渣(主要成分为ZnO,还含有SiO2、Fe3+、Cu2+、Pb2+等杂质)制取ZnCO32Zn(OH)2的一种工艺如下:
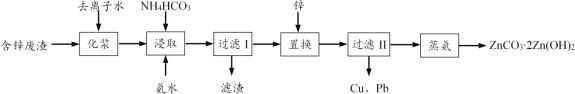
(1)浸取前,需将含锌废渣粉碎并加水制成悬浊液(化浆),目的是____。
(2)浸取时的温度控制在30 ℃,原因是____。浸取后,ZnO转化为[Zn(NH3)4]CO3溶液,滤渣的主要成分为____。
(3)除Cu2+、Pb2+时,也可加入(NH4)2S使其生成硫化物沉淀。已知Ksp(CuS)=6.310-36,Ksp(PbS)=8.010-28,要使溶液中Cu2+、Pb2+的浓度均小于1.010-5 mol·L-1,则沉淀时需控制S2-的浓度至少为_____mol·L-1。
(4)蒸氨时发生反应的化学方程式为____。
(5)本工艺中可循环利用的物质为____。
【答案】增大接触面积,加快浸取速率,提高锌元素的浸出率(答出任意一点即可) 温度太低,浸取反应速率慢;温度太高,NH4HCO3分解(NH3的溶解度减小) Fe(OH)3、SiO2 8.010-23 3[Zn(NH3)4]CO3 + 2H2O![]() ZnCO32Zn(OH)2 + 12NH3+ 2CO2 NH3(多写CO2不扣分)
ZnCO32Zn(OH)2 + 12NH3+ 2CO2 NH3(多写CO2不扣分)
【解析】
根据流程中发生的物理、化学变化,应用化学反应的相关原理,分析解答问题。
(1)将含锌废渣粉碎并制成悬浊液(化浆),可增大浸取时固液接触面积,加快浸取速率,提高锌元素的浸出率。
(2)浸取时使用NH4HCO3和氨水,若温度过高,NH4HCO3会分解、氨溶解度会减小;若温度过低,浸取反应速率慢。浸取时,ZnO转化为[Zn(NH3)4]CO3溶液,杂质Cu2+、Pb2+经置换、过滤II被除去,则杂质Fe3+、SiO2经浸取、过滤I被除去。废渣中的SiO2不溶于NH4HCO3和氨水,Fe3+在碱性浸取液中形成Fe(OH)3沉淀。故滤渣的主要成分为SiO2、Fe(OH)3。
(3)若用(NH4)2S使Cu2+、Pb2+生成硫化物沉淀。因Ksp(CuS)<Ksp(PbS),当c(S2-)相同时,c(Cu2+)<c(Pb2+),故以Ksp(PbS)计算。要c(Pb2+)<1.0×10-5 mol·L-1,代入其溶度积的表达式可以计算出c(S2-)>8.0×10-23mol·L-1 。
(4)过滤II的滤液中含[Zn(NH3)4]CO3,蒸氨时生成NH3、ZnCO32Zn(OH)2,发生非氧化还原反应。据元素守恒,写出配平的方程式3[Zn(NH3)4]CO3 + 2H2O![]() ZnCO32Zn(OH)2 + 12NH3↑+ 2CO2↑。
ZnCO32Zn(OH)2 + 12NH3↑+ 2CO2↑。
(5)“蒸氨”时生成的氨气可用于“浸取”,可循环利用的物质为NH3。

【题目】绿水青山就是金山银山,研究NO2, NO,CO,SO2 等大气污染物和温室效应的治理对建设美丽中国具有重要意义。
(1)已知:NO2(g)+CO(g) ![]() CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2, | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)═2NO(g)△H=+179.5kJmol1 k2
③2NO(g)+O2(g)═2NO2(g)△H=112.3kJmol1 k3
写出NO与CO反应生成无污染气体的热化学方程式为____________.该热化学方程式的平衡常数K为______________(用K1。K2。K3表示)。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)在体积可变的恒压密闭容器中充入1molCO2与足量的碳,让其发生反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

T℃时,若容器中充入惰性气体,v正 ______ v逆(填<,>,=),平衡______移动(填正向,逆向或不。下同),若充入等体积的CO2和CO,平衡_________移动。
650℃时,反应达平衡后CO2的转化率为________。
