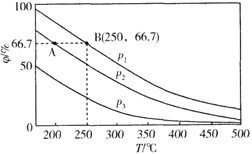
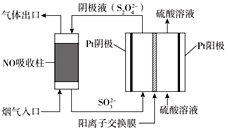
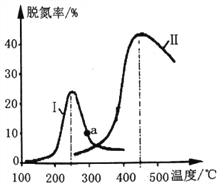
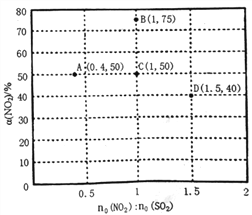
��Ŀ����
����Ŀ����1����״���£�22.4LH2������Ϊ____________g��
��2��9.8g H2SO4�����ʵ���Ϊ__________mol��Լ����___________����ԭ�ӡ�
��3��VL Fe2(SO4)3��Һ�к���ag SO42-,ȡ����Һ0.5L����ˮϡ����2VL,��ϡ�ͺ����Һ��Fe3+�����ʵ���Ũ��Ϊ_________mol/L��
��4����״���£�16 gij��̬������RO2�����Ϊ5.6 L���������Ħ��������________��
��5��b%��������Һ��4b%��������Һ�������Ϻ�������Һ����������______���� �������� = ��ͬ��2.5b%��
��6����ij�¶�ʱ��һ������Ԫ��A����̬�⻯��AH3����һ��������ܱ���������ȫ�ֽ���������嵥�ʣ���ʱѹǿ������75%������A�Ļ�ѧʽΪ____________��
���𰸡�2 0.1 0.4 NA����2.408��1023) a/576V mol/L 64g/mol �� P4
��������
(1) ��״���£�22.4LH2�����ʵ���Ϊ1mol��������Ϊ2g��(2) 9.8g H2SO4�����ʵ���Ϊ9.8g/98g/mol=0.1mol������0.4mol��ԭ�ӣ�������0.4 NA����2.408��1023)�� (3) ag SO42-�����ʵ���Ϊa/96mol���������ӵ����ʵ���Ϊ![]() mol����ˮϡ����4����ϡ�ͺ��Ũ����ԭ��Ũ�ȵ�1/4�������ʵ���Ũ��Ϊ
mol����ˮϡ����4����ϡ�ͺ��Ũ����ԭ��Ũ�ȵ�1/4�������ʵ���Ũ��Ϊ![]() =a/576V mol/L�� (4) ��״���£�5.6 L ����������ʵ���Ϊ5.6L/22.4L/mol=0.25mol������Ħ������Ϊ16g/0.25mol=64g/mol��(5) ��Ϊ������ܶȱ�ˮ�����������������������������Һ���ܶ��������Լ���b%��������Һ���ܶ�Ϊd1��4b%��������Һ���ܶ�Ϊd2������Ϻ���Һ����������Ϊ��d1Vb%+4d2Vb%��/��d1V+d2V������Ϊd1С��d2������Һ��������������2.5b% �� (6) ����������д����ʽΪ��2xAH3=2Ax+3xH2����ȫ�ֽ�ѹǿ������75%��˵����������ʵ�����ԭ����175%����2+3x/2x=175%����x=4����õ����к���4��ԭ�ӣ����Ըõ���ΪP4��
=a/576V mol/L�� (4) ��״���£�5.6 L ����������ʵ���Ϊ5.6L/22.4L/mol=0.25mol������Ħ������Ϊ16g/0.25mol=64g/mol��(5) ��Ϊ������ܶȱ�ˮ�����������������������������Һ���ܶ��������Լ���b%��������Һ���ܶ�Ϊd1��4b%��������Һ���ܶ�Ϊd2������Ϻ���Һ����������Ϊ��d1Vb%+4d2Vb%��/��d1V+d2V������Ϊd1С��d2������Һ��������������2.5b% �� (6) ����������д����ʽΪ��2xAH3=2Ax+3xH2����ȫ�ֽ�ѹǿ������75%��˵����������ʵ�����ԭ����175%����2+3x/2x=175%����x=4����õ����к���4��ԭ�ӣ����Ըõ���ΪP4��