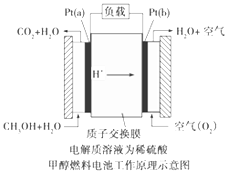
题目内容
【题目】反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g)在一体积可调的密闭容中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加Fe的表面积
B.保持体积不变,充入Ne使体系压强增大
C.将容器的体积缩小一半
D.保持总压强不变,充入Ne使容器的体积增大
【答案】B
【解析】
A.增加Fe的表面积,接触面积增大,反应速率加快,故A不选;
B.保持体积不变,充入Ne使体系压强增大,气体的浓度不变,则反应速率不变,故B选;
C.将容器的体积缩小一半,气体浓度增大,反应速率加快,故C不选;
D.保持总压强不变,充入Ne使容器的体积增大,气体浓度减小,反应速率减小,故D不选;
故选B。

【题目】下列化学事实正确且能用元素周期律解释的是
①原子半径:Cl>P②沸点:HCl>H2S③还原性:S2->C1-④相同条件下电离程度:H2CO3>H2SiO3
A. ①④B. ③④C. ①D. ②③④
【题目】研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
(1)生产水煤气过程中有以下反应: ①C(s)+CO2(g)2CO(g)△H1;
②CO(g)+H2O(g)H2(g)+CO2(g)△H2;
③C(s)+H2O(g)CO(g)+H2(g)△H3;
若平衡表达式为K= ![]() ,则它所对应的化学反应方程式是(填序号) .
,则它所对应的化学反应方程式是(填序号) .
(2)对反应①下列说法中能说明该反应达到平衡状态的 a.温度和体积一定时,混合气体的颜色不再变化
b.温度和体积一定时,容器内的压强不再变化
c.温度和体积一定时,生成物的浓度不再变化
d.温度和体积一定时,混合气体的密度不再变化
(3)不同温度下反应②的平衡常数如下表所示.则△H20(填“<”或“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005molL﹣1、c(H2)=0.015molL﹣1 , 则CO的平衡转化率为 .
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.945795506 | 9 | 1 |
(4)对反应2NO2(g)N2O4(g)△H<0在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示. 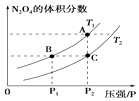
则T1T2(填“>”或“<”);增大压强,平衡移动(填“正反应方向”或“逆反应方向”或“不”);B、C两点的平衡常数BC(填“>”或“<”).