题目内容
6.一定温度下,对于反应:H2(g)+I2(g)?2HI(g),起始时加入氢气、碘蒸气和碘化氢气体的浓度不同,则平衡常数( )| A. | 一定相同 | B. | 一定不同 | C. | 可能不同 | D. | 无法确定 |
分析 依据平衡常数是随温度变化的物理量,不随浓度变化,据此分析判断.
解答 解:一定温度下,对于反应:H2(g)+I2(g)?2HI(g),平衡常数不变,起始时加入氢气、碘蒸气和碘化氢气体的浓度不同对该温度下的平衡常数无影响,
故选A.
点评 本题考查了化学平衡常数影响因素分析判断,平衡常数随温度变化,不随浓度变化,掌握基础是关键,题目较简单.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
17.下列各元素原子排列中,其电负性减小顺序正确的是( )
| A. | K>Li>Na | B. | F>O>S | C. | P>As>N | D. | C>O>N |
14.反应N2(g)+3H2(g)?2NH3(g),下列表示化学反应速率最快的是( )
| A. | v(N2)=0.40 mol•L-1•s-1 | B. | v(NH3)=1.20 mol•L-1•min-1 | ||
| C. | v(NH3)=0.60 mol•L-1•s-1 | D. | v(H2)=0.80 mol•L-1•s-1 |
1.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.
每次实验HNO3的用量为25.0mL、大理石用量为10.00g.提供的试剂还有:HNO3(1.00mol•L-1、2.00mol•L-1)块状大理石、粉末状大理石
请依据实验目的帮助该探究小组完成实验设计表格,并回答相关问题:
实验①和②探究HNO3浓度对该反应速率的影响;
实验①和③探究温度对该反应速率的影响;
实验①和④探究大理石规格(粗、细)对该反应速率的影响;
每次实验HNO3的用量为25.0mL、大理石用量为10.00g.提供的试剂还有:HNO3(1.00mol•L-1、2.00mol•L-1)块状大理石、粉末状大理石
请依据实验目的帮助该探究小组完成实验设计表格,并回答相关问题:
实验①和②探究HNO3浓度对该反应速率的影响;
实验①和③探究温度对该反应速率的影响;
实验①和④探究大理石规格(粗、细)对该反应速率的影响;
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 298 | 块状 | 2.00 |
| ② | |||
| ③ | 308 | 块状 | 2.00 |
| ④ |
18.100℃时,KW=1×10-12,对纯水的叙述正确的是( )
| A. | KW是常温时的10-2倍 | B. | 温度不变冲稀10倍,pH=7 | ||
| C. | pH=6显弱酸性 | D. | c(H+)=10-6mol/L,溶液为中性 |
15.Cu2O是一种红色或黄色的粉末,在工业上可用作有机合成催化剂或电子工业材料等.
(1)工业上可以用Na2SO3 还原CuSO4 的方法制备Cu2O,反应控制的温度为100℃~105℃,pH为3.5~5.5,其反应的化学方程式为2CuSO4+3Na2SO3═Cu2O+3Na2SO4+2SO2↑.也可以用电解法制备,电解时以铜作阳极,氢氧化钠为电解质溶液,写出电解时阳极发生的电极反应:2Cu-2e-+2OH-=Cu2O↓+H2O.
(2)某同学在实验室发现了一瓶使用过的红色粉末,且实验室中只有Fe2O3 和Cu2O两种颜色为红色的试剂,因此他就通过实验来探究该红色粉末的成分,已知Cu2O是一种碱性氧化物,溶于稀H2SO4生成Cu和CuSO4 ,在空气中加热生成CuO.
①请完成Cu2O与稀H2SO4反应的化学方程式:
Cu2O+H2SO4═Cu+CuSO4 +H2O;
②提出合理的假设:
假设1:红色粉末是Fe2O3 ;
假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3 和Cu2O的混合物.
③设计探究实验:
共选择的试剂:3mol•L-1 稀H2SO4、1mol•L-1 NaOH溶液、20%的KSCN溶液,3%的H2O2 溶液,稀HNO3、光亮的铁丝.
(1)工业上可以用Na2SO3 还原CuSO4 的方法制备Cu2O,反应控制的温度为100℃~105℃,pH为3.5~5.5,其反应的化学方程式为2CuSO4+3Na2SO3═Cu2O+3Na2SO4+2SO2↑.也可以用电解法制备,电解时以铜作阳极,氢氧化钠为电解质溶液,写出电解时阳极发生的电极反应:2Cu-2e-+2OH-=Cu2O↓+H2O.
(2)某同学在实验室发现了一瓶使用过的红色粉末,且实验室中只有Fe2O3 和Cu2O两种颜色为红色的试剂,因此他就通过实验来探究该红色粉末的成分,已知Cu2O是一种碱性氧化物,溶于稀H2SO4生成Cu和CuSO4 ,在空气中加热生成CuO.
①请完成Cu2O与稀H2SO4反应的化学方程式:
Cu2O+H2SO4═Cu+CuSO4 +H2O;
②提出合理的假设:
假设1:红色粉末是Fe2O3 ;
假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3 和Cu2O的混合物.
③设计探究实验:
共选择的试剂:3mol•L-1 稀H2SO4、1mol•L-1 NaOH溶液、20%的KSCN溶液,3%的H2O2 溶液,稀HNO3、光亮的铁丝.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量红色粉末于试管中,并加入过量3mol•L-1 稀H2SO4,充分反应后,将上层清液分成两份 | (1)若有红色固体剩余,则假设2,3可能成立; (2)若无红色固体剩余,则假设1,3可能成立 |
| 若步骤1中有红色固体剩余; 步骤2:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液仍为蓝色,则假设2成立; |
| 若步骤1中有红色固体剩余; 步骤3:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液变为血红色,则假设3成立. |
1.下列关于氨的叙述正确的是( )
| A. | 可用向上排空气法收集氨气 | |
| B. | 氨气极易溶于水,因此加热浓氨水不会产生氨气 | |
| C. | 将两根分别蘸有浓氨水和浓硫酸的玻璃棒靠近时,有白烟产生 | |
| D. | 在实验室中,可用加热氢氧化钙和氯化铵的固体混合物的方法制取氨气 |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
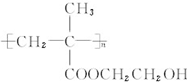 .
.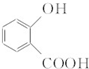 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).