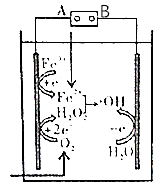
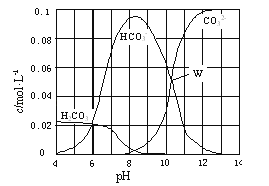
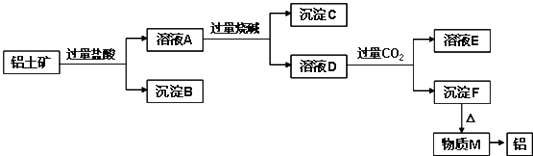
��Ŀ����
����Ŀ����A��B��D��E��F��G���ֶ����ڵ�����Ԫ�أ�A��ԭ�Ӱ뾶��С��B����������������������������2����B��D�г��ȼ����������ۻ�����BD2 �� E+��D2��������ͬ�ĵ��Ӳ�ṹ��G��Dͬ���壬A������F������ȼ�յIJ�������ˮ�õ�һ��ǿ��X����ش��������⣺
��1��BD2�ĽṹʽΪ ��
��2��GԪ����Ԫ�����ڱ��е�λ��Ϊ �� ��GD2���������Ƶ�F���ʵ�ˮ��Һ�����ӷ���ʽΪ ��
��3�������Ԫ���к�AԪ�صĶ�Ԫ���ӻ�����ĵ���ʽΪ �� D��E�γɵĻ��������DZˮ����еĹ���������û�������ˮ��Ӧ�����ӷ���ʽΪ ��
��4��A��B��D��Ԫ������ɵ�ijһԪ��Y���ճ������г�����һ�ֵ�ζ�����ڵ������Ũ�ȵ�X��Y��Һ�м�����״��ͬ��������п�������ߵ�ƽ����Ӧ���ʵĴ�С��ϵ��XY�������������=������
��5����A��D��E��G��Ԫ�ؿ��γ�������ʽ�Σ�����������ʽ����ˮ��Һ�з�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��O=C=O
��2���������ڵڢ�A�壻SO2+Cl2+2H2O=4H++2Cl��+SO42��
��3��![]() ��2Na2O2+2H2O=4Na++4OH��+O2��
��2Na2O2+2H2O=4Na++4OH��+O2��
��4����
��5��NaHSO3+NaHSO4=Na2SO4+SO2��+H2O
���������⣺A��B��D��E��F��G���ֶ����ڵ�����Ԫ�أ�A��ԭ�Ӱ뾶��С����AΪH��B����������������������������2������BΪC��S��B��D�г��ȼ������������ۻ�����BD2 �� ��DΪO��B���������Ϊ+4�ۣ���BΪC��E+��D2��������ͬ�ĵ���������EΪNa��A��F��ȼ�գ���������ˮ�õ�һ��ǿ�ᣬ��FΪCl����1��������BD2 �� Ϊ������̼����ṹʽΪ��O=C=O�� ���Դ��ǣ�O=C=O����2��SԪ��λ�����ڱ��ĵ������ڵ�VIA�壻SO2���л�ԭ�ԣ��������Ƶ���ˮ��Ӧ������������ᣬ�䷴Ӧ�����ӷ���ʽΪ��SO2+Cl2+2H2O=4H++2Cl��+SO42�������Դ��ǣ��������ڵ�VIA�壻SO2+Cl2+2H2O=4H++2Cl��+SO42������3��H����ý��������γ����ӻ�����NaH�������ʽΪ ![]() ��Na��������Ӧ���ɹ������ƣ�����������ˮ��Ӧ�����������ƺ��������䷴Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ�
��Na��������Ӧ���ɹ������ƣ�����������ˮ��Ӧ�����������ƺ��������䷴Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ� ![]() ��2Na2O2+2H2O=4Na++4OH��+O2������4��A��B��D��Ԫ������ɵ�ijһԪ��YΪCH3COOH��XΪ���ᣬ��������������Һ�в��ֵ��룬���ڵ������Ũ�ȵ�CH3COOH��HCl��Һ�У�������������Ũ��С�����Լ�����״��ͬ��������п���������ƽ����Ӧ����С�������ߵ�ƽ����Ӧ���ʵĴ�С��ϵ��X��Y��
��2Na2O2+2H2O=4Na++4OH��+O2������4��A��B��D��Ԫ������ɵ�ijһԪ��YΪCH3COOH��XΪ���ᣬ��������������Һ�в��ֵ��룬���ڵ������Ũ�ȵ�CH3COOH��HCl��Һ�У�������������Ũ��С�����Լ�����״��ͬ��������п���������ƽ����Ӧ����С�������ߵ�ƽ����Ӧ���ʵĴ�С��ϵ��X��Y��
���Դ��ǣ�������5����H��O��Na��S��Ԫ�ؿ��γ�������ʽ�Σ�NaHSO3��NaHSO4 �� ��������ʽ����ˮ��Һ�з�Ӧ����Na2SO4��SO2��ˮ���仯ѧ����ʽΪNaHSO3+NaHSO4=Na2SO4+SO2��+H2O�����Դ��ǣ�NaHSO3+NaHSO4=Na2SO4+SO2��+H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��800��ʱ����2L���ܱ������з�����Ӧ��2NO��g��+O2��g��2NO2 �� n��NO����ʱ��ı仯�����ʾ��
ʱ��Ms | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO���Mmol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����0��3s�ڣ���NO��ʾ��ƽ����Ӧ����v��NO��= ��
��2��ͼ�б�ʾNOŨ�ȱ仯��������������ĸ���ţ��� 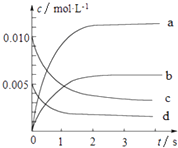
��3����ƽ��ʱNO��ת����Ϊ ��
��4����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ��� A������������ɫ���ֲ���
B�����������ܶȱ��ֲ���
C��v�� ��NO2��=2v�� ��O2��
D����������ƽ����Է����������ֲ���
��5�������µ�850�棬��ƽ���n��NO��=n��NO2������Ӧ���������Ӧ�����淴Ӧ�����ƶ���
��6������һ��������0.2molNO������������Ӧ����ƽ��ʱ��÷ų�������ΪakJ����ʱNOת����Ϊ80%����2molNO������ȫ��Ӧ�ų�������Ϊ ��