题目内容
【题目】I.图中甲池的总反应式为![]() 。
。
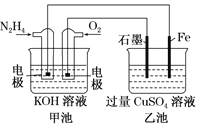
(1)甲池中负极上的电极反应式为_______________。
(2)乙池中石墨电极上发生的反应为______________。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的______________。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为______g。
II.氢能将成为21世纪的主要能源。太阳能光伏电池电解水可制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

(1)制H2时,连接________(填K1或K2),产生H2的电极反应式是_________________,溶液PH___________(填“增大”、“减小”、“不变”)。
(2)改变开关连接方式,可得O2,此时电极3的反应式为:__________________。
【答案】N2H4+4OH--4e-=N2↑+4H2O 2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑ A、C 12.8 K1 2H2O+2e-=H2↑+2OH- 增大 NiOOH+H2O+e-=Ni(OH)2+OH-
【解析】
I.(1)由总反应可知,甲池中负极反应物为N2H4,还原产物为N2,该电解质环境为强碱性,故其电极反应式为:N2H4+4OH--4e-=N2↑+4H2O;
(2)乙池中石墨电极连接的甲池中的正极,故石墨电极为阳极,电解硫酸铜溶液的阳极反应物为水电离出的OH-,故石墨电极上发生的反应为:2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑;
(3)乙池中发生的反应为2CuSO4+2H2O![]() 2Cu↓+O2↑+2H2SO4,若要使电解质溶液恢复至原状态,则需要加入Cu和O,且二者实际加入的原子之比为1:1,故可加入CuO或CuCO3,故答案为A、C;
2Cu↓+O2↑+2H2SO4,若要使电解质溶液恢复至原状态,则需要加入Cu和O,且二者实际加入的原子之比为1:1,故可加入CuO或CuCO3,故答案为A、C;
(4)若要实现在Fe上镀Cu,则Fe作阴极,Cu作阳极;当甲中消耗1.6gN2H4时,即消耗0.05mol N2H4,转移电子的物质的量为:0.05mol×2×2=0.2mol,乙池中Fe电极上析出Cu的物质的量为0.1mol,其电极材料质量增加0.1mol×64g/mol=6.4g,Cu电极上Cu被消耗0.1mol,其质量减少0.1mol×64g/mol=6.4g,故两个电极质量差6.4g+6.4g=12.8g;
II.(1)电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则应连接K1;电极方程式为2H2O+2e-=H2↑+2OH-;该溶液为碱性电解液,电解水的过程中,水被消耗,溶液中溶质浓度增大,pH增大;
故答案为:K1;2H2O+2e-=H2↑+2OH-;增大;
(2)改变开关连接方式时,电极3为阴极,发生还原反应,由图可知,其电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH-。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案