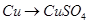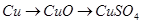题目内容
下列实验报告记录的实验现象正确的是( )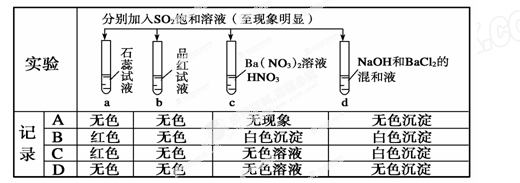
B
解析试题分析:SO2水溶液呈酸性可以使石蕊试液变红,但不褪色;SO2水溶液可以与品红生成无色物质,故而可以漂白品红;SO2被HNO3氧化为H2SO4,H2SO4与Ba(NO3)2反应生成BaSO4白色沉淀;SO2与NaOH反应生成Na2SO3,Na2SO3与BaCl2反应生成BaSO3白色沉淀。故B正确。
考点:考查二氧化硫及其水溶液的化学性质。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
已知硫铁矿在沸腾炉中燃烧,通入的气体原料为空气,其中N2的体积分数为0.8,则沸腾炉中排除的气体中SO2的体积分数可能是( )
| A.0.13 | B.0.16 | C.0.22 | D.0.26 |
下列有关双氧水说法错误的是
| A.H2O2、Na2O2都属于过氧化物,都存在共价键 |
| B.双氧水是绿色氧化剂,可作医疗消毒剂 |
| C.H2O2在过氧化氢酶的催化下,温度越高,分解速率越快 |
| D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
在铁和铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1 g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2之间的关系是
| A.m1一定大于m2 | B.m1可能等于m2 |
| C.m1一定等于m2 | D.m1可能大于m2 |
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是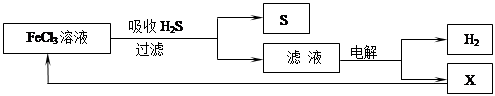
| A.吸收H2S的离子方程式为:2Fe3++H2S→2Fe2++S↓+2H+ |
| B.电解过程中的阳极反应主要为:2Cl-—2e-→Cl2 |
| C.该工艺流程体现绿色化学思想 |
| D.实验室可用点燃充分燃烧的方法消除H2S污染 |
无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为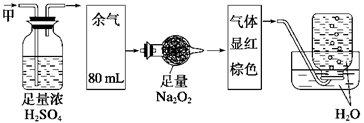
| A.Na2O2在此过程中作氧化剂 | B.甲气体的组成为NH3、NO、CO2 |
| C.甲气体的组成为NH3、NO2、CO2 | D.甲气体中NH3的体积分数为20% |
已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是…( )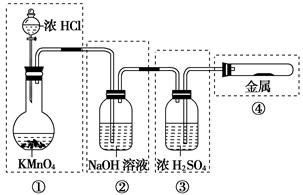
| A.①和②处 | B.②处 | C.②和③处 | D.②③④处 |