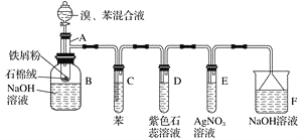
题目内容
【题目】酸燃料电池以Ca(HSO2)2固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是
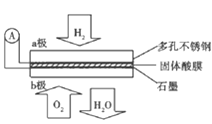
A.电子通过外电路从a极流向b极
B.b极上的电极反应式为:O2+4H+=+4e+=2H2O
C每转移0.4mol电子,生成3.6g水
D.H+由b极通过固体酸电解质传递到a极
【答案】D
【解析】
试题分析:根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-=2H+;通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水。A.a为负极,b是正极,则电子应该是通过外电路由a极流向b,正确;B.该电池为酸性电池,所以正极电极反应为O2+4e-+4H+=2H2O,正确;C.每转移0.4 mol电子,生成0.2mol水,质量是0.2mol×18g/mol=3.6g,正确;D.原电池中,阳离子向正极移动,所以H^+ 由a极通过固体酸电解质传递到b极,错误。

练习册系列答案
相关题目