题目内容
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-QkJ/mol (Q>0) 在850℃时,K=1。
CO2(g)+H2(g) △H=-QkJ/mol (Q>0) 在850℃时,K=1。
①写出该反应的化学平衡常数的表达式K=__________。
②若升高温度到950℃,达到平衡时K____1 (填“大于”“ 小于”或“等于”),理由是__________。
③ 850℃时,若向一容积可变的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2和xmolH2,则:当x=5.0时,上述反应向_______________方向进行(填“正反应”或“逆反应”)。
④上述反应达平衡后,扩大该容器体积,平衡___________(正向移动、逆向移动或不移动)。
【答案】 c(CO2)·c(H2)/c(CO)·c(H2O) 小于 此反应为放热反应,升高温度,平衡向逆向移动 逆反应 不移动
【解析】①反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的化学平衡常数的表达式K=
CO2(g)+H2(g)的化学平衡常数的表达式K=![]() ;②反应:CO(g)+H2O(g)
;②反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-QkJ/mol (Q>0)是放热反应,若升高温度,平衡逆向移动,平衡常数减小,故升高温度到950℃,达到平衡时K小于1;③850℃时,若向一容积可变的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2和xmolH2,当x=5.0时,设容器的体积为V,则有:Q=
CO2(g)+H2(g) △H=-QkJ/mol (Q>0)是放热反应,若升高温度,平衡逆向移动,平衡常数减小,故升高温度到950℃,达到平衡时K小于1;③850℃时,若向一容积可变的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2和xmolH2,当x=5.0时,设容器的体积为V,则有:Q=![]() =
= =
=![]() >1,此时生成的浓度偏大,而在同一温度下平衡常数保持不变,则必然随着反应的进行,生成物的浓度降低,平衡逆向移动;④反应CO(g)+H2O(g)
>1,此时生成的浓度偏大,而在同一温度下平衡常数保持不变,则必然随着反应的进行,生成物的浓度降低,平衡逆向移动;④反应CO(g)+H2O(g)![]() CO2(g)+H2(g)是气体体积不变的反应,改变压强不能使平衡移动。故达平衡后,扩大该容器体积,相当于减小压强,平衡不移动。
CO2(g)+H2(g)是气体体积不变的反应,改变压强不能使平衡移动。故达平衡后,扩大该容器体积,相当于减小压强,平衡不移动。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
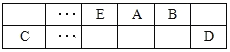
小学能力测试卷系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2SO3 | Na2SiO3溶 | 非金属性:S>Si | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D