题目内容
【题目】水是生命之源,与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)H2O水分子的VSEPR模型为_______形,氧原子的杂化方式为_____
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+),用电子式表示它的形成过程为___________________________,
(3)对于(2)中涉及的变化过程的描述不合理的是________。
a.氧原子的杂化类型发生了改变 b.微粒的形状发生了改变
c.微粒的化学性质发生了改变 d.微粒中的键角发生了改变
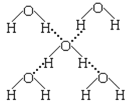
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol(设气态水中无氢键)。
【答案】四面体 sp3 ![]() a 20
a 20
【解析】
计算O原子价层电子对数,确定水分子VSEPR模型及杂化类型;根据形成配位键,用电子式写出形成过程;根据水中氧的杂化为sp3,H3O+中氧的杂化为sp3,据此判断不合理选项;利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能。
(1)H2O中价层电子对个数=2+![]() =4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3;答案为四面体,sp3。
=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3;答案为四面体,sp3。
(2)H2O中O原子存在孤对电子,H+有空轨道,以配位键的形式结合成水合氢离子(H3O+),用电子式表示它的形成过程为![]() ;答案为
;答案为![]() 。
。
(3)a.水分子中O原子价层电子对个数=2+![]() =4,所以采用sp3杂化,H3O+中氧原子价层电子对个数=3+
=4,所以采用sp3杂化,H3O+中氧原子价层电子对个数=3+![]() =4,所以采用sp3杂化,则氧原子的杂化类型没有改变,故a错误;
=4,所以采用sp3杂化,则氧原子的杂化类型没有改变,故a错误;
b.水分子中O原子采用sp3杂化,且O原子含有2个孤电子对,所以其空间构型为V形结构;H3O+中O原子采用sp3杂化,且O原子含有1个孤电子对,所以其空间构型为三角锥型,则微粒的形状发生了改变,故b正确;
c.H2O为中性分子,H3O+为酸性的阳离子,微粒的化学性质发生了改变,故c正确;
d.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故d正确;
答案为a。
(4) 冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,每个水分子与相邻的4个水分子形成氢键,每根氢键属于2个水分子,则1mol水中含有2mol氢键,升华热=范德华力+氢键,所以氢键=升华热-范德华力,冰晶体中氢键的“键能”= ![]() =20kJ/mol;答案为20。
=20kJ/mol;答案为20。