题目内容
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为非气态
C.平衡体系中加入少量C,平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
【答案】
A
【解析】
试题分析:密度是混合气的质量和容器容积的比值,在反应过程中容器容积是不变的。由于达到化学平衡后,升高温度,容器内气体的密度增大,这说明气体的质量是增加的。所以如果正反应是吸热反应,则平衡向正反应方向移动。由于C是固态,所以此时A一定不是气态,选项A正确;如果正反应是放热反应,则平衡向逆反应方向移动。由于C是固态,所以此时A一定也是气态,B不正确;改变固态的质量,不会影响平衡状态,C不正确;根据以上的讨论可知,该反应前后气体体积一定是变化的,所以改变压强对该平衡的移动一定有影响,D不正确,答案选A。
考点:考查平衡状态的判断、外界条件对平衡状态的影响
点评:影响平衡状态的外界条件一般是温度、浓度和压强。在使用时除了注意利用勒夏特例原理外,还需要特别注意体积的使用范围。例如浓度不能适用于固态或纯液态,压强只能适用于气体体系等。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在容积不变的密闭容器中进行反应:2SO2( g )+O2( g)?2SO3(g );△H<O.如图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
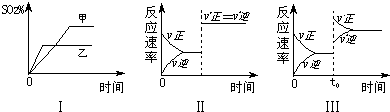

| A、图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 | B、图Ⅱ表示t0时刻使用催化剂对反应速率的影响 | C、图Ⅱ表示t0时刻通入氦气对反应速率的影响 | D、图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |