题目内容
已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13
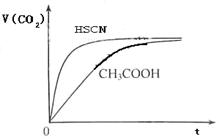
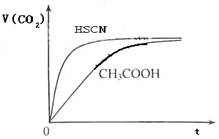
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图1.反应开始时,两种溶液产生CO2的速率明显不同的原因是 ;
反应结束后所得溶液中c(SCN-) c(CH3COO-)(填“>”,“=”或“<”)
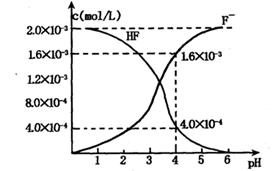
(2)2.0×10-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如图2.
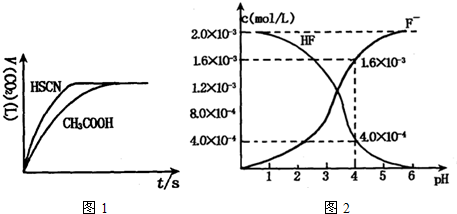
则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=
(3)难溶物质CaF2溶度积常数为:Ksp=1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4mol/L的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成? (填“有”或“没有”),筒述理由: .
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图1.反应开始时,两种溶液产生CO2的速率明显不同的原因是
反应结束后所得溶液中c(SCN-)
(2)2.0×10-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如图2.

则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=
(3)难溶物质CaF2溶度积常数为:Ksp=1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4mol/L的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?
分析:(1)等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大;由图象可知反应生成的二氧化碳相同,则消耗的碳酸氢钠相同,反应后应分别为CH3COONa、NaSCN,结合水解程度和电荷守恒判断;
(2)根据Ka(HF)=
计算;
(3)根据ksp(CaF2)=c(Ca2+)?c2(F-)计算.
(2)根据Ka(HF)=
| c(H+)?c(F-) |
| c(HF) |
(3)根据ksp(CaF2)=c(Ca2+)?c2(F-)计算.
解答:解:(1)等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大,因Ka(HSCN)>Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH,c(H+)大反应速率快;由图象可知反应生成的二氧化碳相同,则消耗的碳酸氢钠相同,反应后应分别为CH3COONa、NaSCN,因Ka(HSCN)>Ka(CH3COOH),则CH3COONa水解程度较低,则溶液中c(CH3COO-)较小,
故答案为:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快;>;
(2)由图象可知,当pH=4时,c(H+)=1.0×10-4mol/L,c(HF)=4.0×10-3mol/L,c(F-)=1.6×10-3mol/L,
则Ka(HF)=
=
=4.0×10-4,
故答案为:Ka(HF)=
=
=4.0×10-4;
(3)将4.0×10-3mol/L HF溶液与4.0×l0-4mol/L的CaCl2溶液等体积混合,调节溶液pH=4,
此时c(F-)=
=
,解得c(F-)=1.6×10-3(mol/L),c(Ca2+)=2.0×l0-4mol/L,
则溶液中c(Ca2+)?c2(F-)=2.0×l0-4×(1.6×10-3)2=5.12×10-10>ksp(CaF2)=1.5×10-10,
则有沉淀生成,
故答案为:有;因为溶液中c(Ca2+)?c2(F-)=5.12×10-10>ksp(CaF2)=1.5×10-10.
故答案为:因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+)为HSCN>CH3COOH,c(H+)大反应速率快;>;
(2)由图象可知,当pH=4时,c(H+)=1.0×10-4mol/L,c(HF)=4.0×10-3mol/L,c(F-)=1.6×10-3mol/L,
则Ka(HF)=
| c(H+)?c(F-) |
| c(HF) |
| 1×10-4×1.6×10-3 |
| 4.0×10-4 |
故答案为:Ka(HF)=
| c(H+)?c(F-) |
| c(HF) |
| 1×10-4×1.6×10-3 |
| 4.0×10-4 |
(3)将4.0×10-3mol/L HF溶液与4.0×l0-4mol/L的CaCl2溶液等体积混合,调节溶液pH=4,
此时c(F-)=
| c(HF)×4.0×10-4 |
| c(H+) |
| (2.0×10-3-c(F-))×4.0×10-4 |
| 1×10-4 |
则溶液中c(Ca2+)?c2(F-)=2.0×l0-4×(1.6×10-3)2=5.12×10-10>ksp(CaF2)=1.5×10-10,
则有沉淀生成,
故答案为:有;因为溶液中c(Ca2+)?c2(F-)=5.12×10-10>ksp(CaF2)=1.5×10-10.
点评:本题考查较为综合,涉及弱电解质的电离、平衡常数的计算以及难溶电解质的溶解,侧重于学生的分析能力和计算能力的考查,为高频考点,注意相关计算公式的运用,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目