题目内容
1. 某研究性学习小组设计了一组实验验证元素周期律.非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某研究性学习小组设计了一组实验验证元素周期律.非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.①写出所选用物质的化学式:A、硝酸; B、碳酸钙;C、硅酸钠.
②写出烧瓶中发生反应的化学方程式:2HNO3+Na2CO3=NaNO3+CO2↑+H2O
③写出烧杯中发生反应的化学方程式:CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3
④碳、氮、硅元素的非金属性强弱顺序为N>C>Si.
分析 ①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,据此解答;
②硝酸与碳酸钙反应生成硝酸钙、二氧化碳和水;
③二氧化碳、水与硅酸钠反应生成硅酸沉淀和碳酸钠;
④依据最高价氧化物对应水化物酸性越强,元素非金属性越强.
解答 解:①利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠;
故答案为:硝酸;碳酸钙;硅酸钠;
②硝酸与碳酸钙反应生成硝酸钙、二氧化碳和水,化学方程式:2HNO3+Na2CO3=2NaNO3+CO2↑+2H2O,故答案为:2HNO3+Na2CO3=2NaNO3+CO2↑+2H2O;
③二氧化碳、水与硅酸钠反应生成硅酸沉淀和碳酸钠,化学方程式:CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,故答案为:CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3;
④依据反应可知:硝酸的酸性强于碳酸,碳酸的酸性强于硅酸,所以非金属性强弱关系为:N>C>Si,故答案为:N>C>Si.
点评 本题考查了实验的设计,熟悉元素非金属性强弱判断依据及硝酸、碳酸、硅酸酸性强弱是解题关键,题目难度不大.

练习册系列答案
相关题目
12.在一定温度下,反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 单位时间内生成n molA2同时生成n mol AB3 | |
| B. | 容器内的总物质的量不随时间变化 | |
| C. | 单位时间内生成2n mol AB3的同时生成n molB2 | |
| D. | 单位时间内生成n molA2的同时生成n molB2 |
9.下列各组顺序的排列不正确的是( )
| A. | 金属性:Na>Mg>Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性性强弱:NaOH>Mg(OH)2>Al(OH)3 | D. | 非金属性:F>Cl>S>O |
6.下列说法中正确的是( )
| A. | 用完的电池可以随意地丢弃 | |
| B. | 增加炼铁高炉的高度可以降低尾气中CO的含量 | |
| C. | 实验室用一定质量的锌和过量的稀硫酸反应制取氢气时,加入少量硫酸铜可以加快反应速率且生成氢气的量不变 | |
| D. | 把煤粉碎后再燃烧可以提高煤的燃烧效率 |
13.下列物质的熔、沸点高低顺序不正确的是( )
| A. | F2<Cl2<Br2<I2 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | HCl<HBr<HI<HF | D. | CH4<SiH4<GeH4<SnH4 |
10.某有机物的结构如图所示,下列有关它的说法正确的是( )


| A. | 该有机物的分子式为:C10H9O5Br | |
| B. | 该有机物能发生银镜反应 | |
| C. | 1mol该有机物能与含3mol Br2的溴水发生加成反应 | |
| D. | 该有机物与热的NaOH溶液反应后有HOCH2COONa生成 |

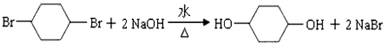 ;
; ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
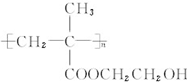 .
.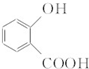 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).