题目内容
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g)+3D(g) ΔH<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
C(g)+3D(g) ΔH<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
下列分析中不正确的是( )
| A.图Ⅰ可体现t0时升高温度对反应速率的影响 |
| B.图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高 |
C
解析

练习册系列答案
相关题目
在密闭容器中的一定量混合气体发生反应:  平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
| A.B的转化率降低 |
| B.x+y<z |
| C.平衡向正反应方向移动 |
| D.C的体积分数增大 |
在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=?92. 4kJ·mol-1)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
| NH3的浓度( mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
A.2p1=2p3<p2 B.达到平衡时丙容器中NH3的体积分数最大
C.α2+α3<1 D.Q3+92.4 c1=92.4
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
| A.v正 增大,v逆减小 | B.v正减小,v逆增大 |
| C.v正和v逆同程度的减小 | D.v正和v逆不同等程度的减小 |
已知(CH3COOH)2(g) 2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量( )随温度(T)的变化曲线如图所示,下列说法正确的是( )
)随温度(T)的变化曲线如图所示,下列说法正确的是( )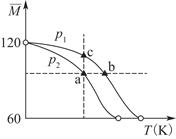
| A.该过程的ΔH<0 |
| B.气体压强:p(a)<p(b)=p(c) |
| C.平衡常数:K(a)=K(b)<K(c) |
| D.测定乙酸的相对分子质量要在高压、低温条件 |
下列叙述中,不能用平衡移动原理解释的是( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
下列条件一定能使反应速率加快的是( )。
①增加反应物的物质的量 ②升高温度 ③增大反应体系的压强 ④不断分离出生成物 ⑤加入MnO2
| A.全部 | B.①②⑤ | C.② | D.②③ |
在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若要提高CO的转化率,则应该加入适当的过量FeO |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.026" 3 mol/L |
 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。