题目内容
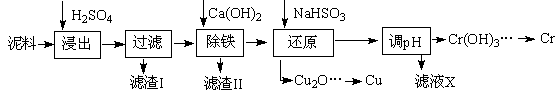
(12分)海水综合利用的工艺流程图如下:
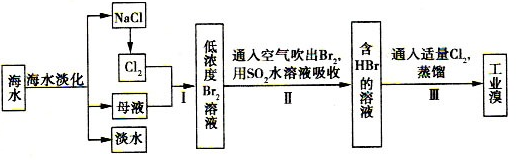
(l)步骤II用SO2水溶液吸收Br2,吸收率可达95%。
①有关反应的离子方程式为 ;
②该过程中除环境保护外,在工业生产中应解决的主要问题是 ;
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是 ;实验室中采用 方法可以起到同样的作用。
(3)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在氯化氢氛围下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①写出直接加热MgCl2·6H2O的化学方程式 ;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由: 。

(l)步骤II用SO2水溶液吸收Br2,吸收率可达95%。
①有关反应的离子方程式为 ;
②该过程中除环境保护外,在工业生产中应解决的主要问题是 ;
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是 ;实验室中采用 方法可以起到同样的作用。
(3)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在氯化氢氛围下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①写出直接加热MgCl2·6H2O的化学方程式 ;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由: 。
(1)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀
(2)富集溴元素 萃取分液
(3)①MgCl2·6H2O
 MgO+2HCl↑+5H2O
MgO+2HCl↑+5H2O②不同意,因为MgO的熔点很高,熔融时会耗费大量的能量而增加成本。
试题分析:(1)反应产生强酸,具有腐蚀作用;(2)步骤I中已获得Br2是低浓度的,需要进一步富集达到工业生产的目的;实验室中采用有机溶剂萃取分液的方法达到富集溴;(3)将MgCl2·6H2O在加热时会发生水解生成氢氧化镁,氢氧化镁受热分解得到氧化镁,故应在HCl气氛中加热,抑制MgCl2水解;因为MgO的熔点很高,熔融时会耗费大量的能量而增加成本,所以采用电解MgCl2。

练习册系列答案
相关题目

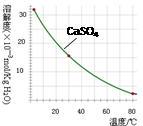
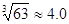 )
) 2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4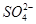 +2H2O
+2H2O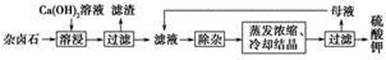
 ?
? CaCO3(s)+
CaCO3(s)+