题目内容
(10分)硫酸是工业生产中最为重要的产品之一。在催化反应室里进行的反应为:
2SO2(g)+O2(g) 2SO3(g) ΔH= –196.6 kJ·mol-1
2SO3(g) ΔH= –196.6 kJ·mol-1
(1)该反应发生的条件通常是400~500℃、 和 。
(2)SO3在 (填设备名称)中用 (填试剂名称)吸收。
(3)研究SO2 、NO2、CO等大气污染气体的处理具有重要意义。
已知: 2NO(g)+O2(g) 2NO2(g)
ΔH= –113.0 kJ·mol-1
2NO2(g)
ΔH= –113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=
kJ·mol-1。
SO3(g)+NO(g)的ΔH=
kJ·mol-1。
一定条件下,将NO2与SO2以物质的量之比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2的物质的量之比为1:6,则平衡常数K= 。
(10分)(1)常压 催化剂(每空1分)
(2)吸收塔 98%硫酸(每空1分)
(3)–41.8 b 2.67或8/3(每空2分)
【解析】略

[化学——选修化学与技术](15分)
硫酸是工业生产中最为重要的产品之一。
(1)工业上制硫酸主要分为_________、________、_________三个阶段。
(2)下列是第二阶段反应的有关实验数据,请选择最合适的生产条件____________。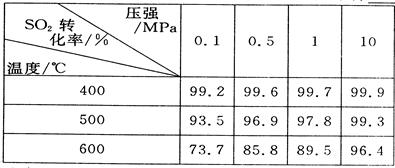
(3)现在欲提高反应速率和SO2的转化率,下列措施可行的是( )
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
(5)若进入第二阶段所用设备中气体的体积分数为:SO27%、O211%、N282%。现有100体积这样的混合气体在反应后变成96.7体积,则反应后混合气体中N2和SO3的体积比为___________,此时SO2转化率为__________。
 2SO3(g) ΔH=" –196.6" kJ·mol-1
2SO3(g) ΔH=" –196.6" kJ·mol-1