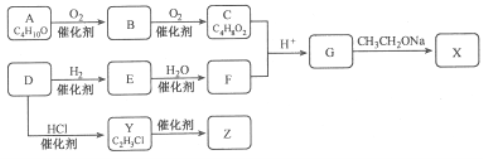
题目内容
【题目】用电子式表示下列物质的结构:
(1)NH4Cl;
(2)Na2O2;
(3)CO2;
(4)MgCl2;(1)~(6)中,仅含离子键的是 , 仅含共价键的是 , 既有离子键又有共价键的是 .
【答案】
(1)![]()
(2)![]()
(3)![]()
(4)![]() ;(1)(2)(4);(3);(1)(2)
;(1)(2)(4);(3);(1)(2)
【解析】(1)氯化铵是离子化合物,由氨根离子与氯离子构成,铵根离子内部,氮原子与氢原子通过共价键结合,电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(2)Na2O2是离子化合物,由Na+离子和O2﹣离子构成,过氧根离子内部两个氧原子共用一对电子,Na2O2的电子式为:
;(2)Na2O2是离子化合物,由Na+离子和O2﹣离子构成,过氧根离子内部两个氧原子共用一对电子,Na2O2的电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
;(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(4)氯化镁是离子化合物,由镁离子与氯离子构成,电子式为
;(4)氯化镁是离子化合物,由镁离子与氯离子构成,电子式为 ![]() ,故答案为:
,故答案为: ![]() ;氯化铵含有离子键和共价键;过氧化钠含有离子键和共价键;二氧化碳只含共价键;氯化镁只含离子键;
;氯化铵含有离子键和共价键;过氧化钠含有离子键和共价键;二氧化碳只含共价键;氯化镁只含离子键;
所以:(1)~(6)中,仅含离子键的是(1)(2)(4),仅含共价键的是(3),既有离子键又有共价键的是(1)(2);
故答案为:(1)(2)(4);(3);(1)(2);
(1)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,铵根离子内部,氮原子与氢原子通过共价键结合,氯化铵含有离子键和共价键;(2)Na2O2是离子化合物,由Na+离子和O22﹣离子构成,过氧根离子内部两个氧原子共用一对电子,过氧化钠含有离子键和共价键;(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳只含共价键;(4)氯化镁是离子化合物,由镁离子与氯离子构成,注意电子式中相同离子不能合并,氯化镁只含离子键;

练习册系列答案
相关题目