��Ŀ����
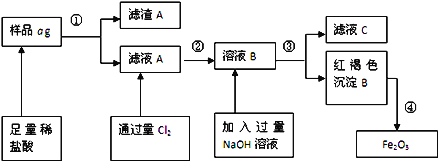
����Ŀ��ij����֣���Ҫ�ɷ�ΪFe����Ʒ�к�������ͭ����ȣ������ɷֺ��ԣ���Ϊ�˲ⶨ�úϽ������ĺ���������������¹������̣�
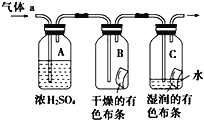
��1������A����Ҫ����__________��__________��������ʹ�õIJ���������__________
��2��д������ҺA��ͨ��Cl2����������Ӧ�����ӷ���ʽ:__________,д���������NaOH��Һ��������Ӧ�����ӷ���ʽ__________.
��3��ʵ���ҽ��в�����õ�������������ǯ���ƾ��ơ����żܡ�__________��__________
��4��������Fe2O3�������������Ϊb g���������Ʒ����Ԫ�ص������ٷ����ı���ʽΪ__________���ú�a��b��ʽ�ӱ�ʾ��
��5����ͬѧ�������Լ��������һ����,Ҳ�ﵽ��ͬ����Ŀ�ģ����μ�����Լ��ǣ��������� NaOH��Һ��__________��__________�� �������� NaOH��Һ���������յ�Fe2O3������
���𰸡� �衢ͭ ©�����ձ��������� 2 Fe2��+Cl2 �� 2Fe3��+ 2Cl�� Fe3�� + 3OH�� �� Fe(OH)3�� Al3�� + 4OH�� �� AlO2�� +2H2O ���� ������ (7b/10a)��100% {��(70b/a)%} ������������ ͨ��������
����������������������(��Ҫ�ɷ�ΪFe)��Ʒ�к�������ͭ�ȣ���������ϡ�����������ܽ�Ϊ�Ȼ��������Ȼ�����Һ��ͭ���費�ܽ⣬���˵õ�����AΪͭ���裬��ҺA�к��е����ʳɷ�ΪFeCl2��AlCl3��ͨ���������Ȼ���������Ϊ�Ȼ�����2FeCl2+Cl2=2FeCl3���õ���ҺB��ΪFeCl3��AlCl3��B��Һ�м����������������Һ��ӦΪ:FeCl3+3NaOH=Fe(OH)3��+3NaCl��AlCl3+4NaOH=NaAlO2+3NaCl�����˵õ����ɫ����������������ҺC����ҺC�к��е�����NaAlO2��NaCl��NaOH�����ɫ���������������ȷֽ�õ���������
�������������Ϸ�������1������A����Ҫ����ͭ���裻�����ǹ��ˣ�����ʹ�õIJ���������©�����ձ���������
��2����ҺA��FeCl2��AlCl3��ͨ��Cl2���������Ȼ���������Ϊ�Ȼ���������������Ӧ�����ӷ���ʽ: 2 Fe2��+Cl2 �� 2Fe3��+ 2Cl�� ��FeCl3��AlCl3�����NaOH��Һ��������Ӧ�����ӷ���ʽFe3��+ 3OH���� Fe(OH)3���� Al3��+ 4OH���� AlO2��+2H2O ��
��3������������գ��õ�������������ǯ���ƾ��ơ����żܡ���������������
��4��������Ԫ���غ㣬����Ʒ����Ԫ�ص������ٷ����ı���ʽΪ![]() (7b/10a)��100%
(7b/10a)��100%
��5����ͬѧ�������Լ��������һ����,Ҳ�ﵽ��ͬ����Ŀ�ģ����μ�����Լ��ǣ��������� NaOH��Һ���������ܽ���������������м��������������Ȼ�����������������Һ��ͨ���������Ȼ���������Ϊ�Ȼ������� �������� NaOH��Һ���������յ�Fe2O3������

 ��ҵ����ϵ�д�
��ҵ����ϵ�д�����Ŀ��ij�Ͻ��������������ʵıȽ������ʾ�� ��
��Ŀ | �۵�/��C | �ܶ�/ | Ӳ�ȣ���� | ������ |
ij�Ͻ� | 2 500 | 3.00 | 7.4 | 2.3 |
�� | 1 535 | 7.86 | 4.5 | 17 |
�����ܿ����úϽ��ʺ��ƣ� ��
A.����
B.�Ŵ���
C.¯��
D.�ɻ����