题目内容
【题目】下列各数值表示元素原子序数,在各组中能以离子键相互结合成稳定化合物的是( )
A. 10和19 B. 6和16 C. 11和17 D. 14和8
【答案】C
【解析】A.10和19分别是Ne、K,不能形成化合物,A错误;B.6和16分别是C和S,形成共价化合物CS2,B错误;C.11和17分别是Ma、Cl,形成离子化合物NaCl,C正确;D.14和8分别是Si、O,形成共价化合物SiO2,D错误,答案选C。

 名校课堂系列答案
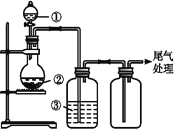
名校课堂系列答案【题目】可用如图装置制取、净化、收集气体的是
选项 | 气体 | ① | ② | ③ |
|
A | NH3 | 浓氨水 | 生石灰 | 浓硫酸 | |
B | SO2 | 浓硫酸 | Na2SO3 | 浓硫酸 | |
C | NO2 | 浓硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | MnO2 | H2O |
A. A B. B C. C D. D
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
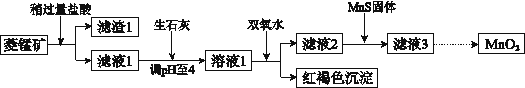
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)盐酸溶解MnCO3的化学方程是______________,滤渣1的主要成分为________________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________________,在CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=_____________ (Ksp(CuS)=1.2×10-36,Ksp(MnS)=2.5×10-13)。
(4)在酸性条件下,NaClO3溶液将MnCl2氧化为MnO2,其还原产物为Cl2,该反应的离子方程式为 ___________________ 。
【题目】欲降低废水中重金属元素铬的毒性,可将![]() 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:
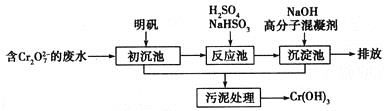
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________。
②请补充并配平以下反应池中发生主要反应的离子方程式:____![]() +____
+____![]() +____===____Cr3++____
+____===____Cr3++____![]() +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________。证明Cr3+沉淀完全的方法是_____________________________________________________________。
(2)工业可用电解法来处理含![]() 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含![]() 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
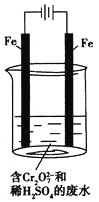
①Fe2+与酸性溶液中的![]() 反应的离子方程式是______________________________。
反应的离子方程式是______________________________。
② 若溶液中含有0.01 mol ![]() ,则阳离子全部生成的沉淀的物质的量是______mol。
,则阳离子全部生成的沉淀的物质的量是______mol。