题目内容
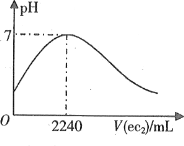
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如下图所示,则比较下列大小关系:
(1)三种金属的活动性由强到弱的顺序为:________________________。
(2)三种金属反应时消耗硫酸的质量由少到多的顺序为:_____________。
(3)三种金属的相对原子质量由大到小的顺序为:________________。
【答案】甲>丙>乙 丙<乙<甲 丙>乙>甲
【解析】
由产生氢气的体积与反应时间的关系图,等质量的甲最先完成反应而乙最后反应完成;完全反应后甲放出氢气量最大而丙最小,以此解答。
(1)等质量的甲、乙、丙三种金属,甲最先完成反应,其次为丙,而乙最后反应完全,因此可判断三种金属的活动性大小为甲>丙>乙;
(2)反应所放出氢气全部来自于稀硫酸,产生的氢气越多,消耗硫酸的质量越大,故三种金属反应时消耗硫酸的质量由少到多的顺序为:丙<乙<甲;
(3)根据一定量金属完全反应产生氢气质量=![]() ×金属的质量,因金属的质量及化合价均相同,所以金属的相对原子质量与反应放出氢气的多少成正比,则三种金属的相对原子质量是丙>乙>甲。
×金属的质量,因金属的质量及化合价均相同,所以金属的相对原子质量与反应放出氢气的多少成正比,则三种金属的相对原子质量是丙>乙>甲。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】设NA为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ΔH1 = a kJ mol-1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ΔH2 = bkJ mol-1
其他数据如下表所示,下列说法正确的是
化学键 | C=O | C—H | O—H | O=O |
键能/(kJ mol-1) | 798 | 413 | 463 | x |
A.ΔH1 < ΔH2
B.H2O(g) = H2O(1) ΔH=(a-b)kJ mol -1
C.当有4NA个O-H键生成时,反应放出的热量为a kJ
D.上文中x =![]()