题目内容
【题目】“漂粉精”Ca(ClO)2与密度为1.19g·cm-3质量分数为36.5%的HCl溶液反应生成Cl2,该化学方程式为:Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑ + 2H2O
(1)浓盐酸在反应中显示出来的性质是____________ (填写字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)用双线桥法表示该氧化还原反应中电子转移情况_________________。
(3)标准状况下若产生4.48L Cl2,则反应过程中被氧化的HCl的物质的量是___。
(4)某同学欲用该浓盐酸配制100mL1mol·L﹣1HCl溶液.回答下列问题:
①需取用该浓盐酸体积为________。
②配制1mol·L﹣1HCl溶液时需用的主要仪器有烧杯、量筒、玻璃棒、胶头滴管、___。
③不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响偏小的是__。(请填序号)
A.容量瓶中原有少量蒸馏水 B.定容时俯视刻度线
C.玻璃棒在刻度线上方引流溶剂水 D.颠倒摇匀后发现凹液面低于刻度线但没加水
【答案】 B 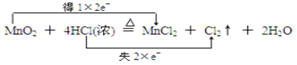 0.2 mol 8.4mL 100mL容量瓶 C
0.2 mol 8.4mL 100mL容量瓶 C
【解析】本题主要考查一定物质的量浓度溶液的配制方法。
(1)浓盐酸中Cl-一半被氧化,另一半保留,所以浓盐酸在反应中显示出来的性质是还原性和酸性,故选B。
(2)用双线桥法表示该氧化还原反应中电子转移情况: 。
。
(3)标准状况下若产生4.48L即0.2molCl2,Cl2来自于被氧化的HCl,则反应过程中被氧化的HCl的物质的量是0.2mol。
(4)①c浓=![]() =
=![]() ==11.9mol/L,c浓V浓= c稀V稀,V浓=8.4mL,故需取用该浓盐酸体积为8.4mL。
==11.9mol/L,c浓V浓= c稀V稀,V浓=8.4mL,故需取用该浓盐酸体积为8.4mL。
②配制1mol·L﹣1HCl溶液时需用的主要仪器有烧杯、量筒、玻璃棒、胶头滴管、100mL容量瓶。
③A.对实验结果没有影响;B.所配溶液体积变小,对实验结果的影响偏大;C.刻度线上方残留溶剂水,所配溶液体积变大,对实验结果的影响偏小;D.对实验结果没有影响。故选C。



