题目内容
8.环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境.某化学兴趣兴趣小组尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮.有关物质信息、实验流程如图1及实验装置如图2如下:环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,相对水的密度:0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g (31℃). 回答下列问题:
回答下列问题:(1)仪器A的名称是三颈烧瓶.
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有搅拌器搅拌、缓慢滴加NaClO溶液.
(3)加入饱和NaHSO3溶液时发生的主要反应是ClO-+HSO3-═Cl-+H++SO42-(用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量.
(4).为将馏出液的pH调至中性,可以加入的试剂是BD.
A、稀盐酸 B、无水碳酸钠 C、浓硫酸 D、氢氧化钠固体
(5)调节pH后还需加入精制食盐,其目的是降低环己酮的溶解度,有利于环己酮分层,“取有机层”时使用的主要仪器是c.(填图3对应的字母).
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究.他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定.具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3═2NaI+Na2S4O6.则该NaClO溶液的浓度是1.800mol/L.
分析 (1)根据实验装置图及常见的仪器分析;
(2)搅拌加速热量传递,NaClO水解吸热;
(3)次氯酸根能将亚硫酸氢根氧化,已经足量时溶液中无次氯酸根,可以用碘化钾淀粉试纸检验是否有次氯酸根;
(4)由(3)中分析可知溶液呈酸性;
(5)环己酮在氯化钠中的溶解度较小,环己酮和水互不相溶;
(6)NaClO溶液中加入适量稀盐酸和KI固体(足量),发生的反应为:ClO-+2I-+2H+=Cl-+I2+H2O,再用0.1000mol/L Na2S2O3标准溶液滴定,发生的反应为:I2+2Na2S2O3═2NaI+Na2S4O6,根据已知反应物质之间的关系计算.
解答 解:(1)由实验装置图可知,图2中仪器A的名称是三颈烧瓶,故答案为:三颈烧瓶;
(2)为了将体系温度维持在30~35℃,要不断搅拌加速热量传递,而且NaClO水解吸热,因此要缓慢滴加NaClO溶液,
故答案为:搅拌器搅拌;缓慢滴加NaClO溶液;
(3)次氯酸根能将亚硫酸氢根氧化生成氯离子、硫酸根离子和氢离子,其离子方程式为:ClO-+HSO3-═Cl-+H++SO42-;已经足量时溶液中无次氯酸根,取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量,
故答案为:ClO-+HSO3-═Cl-+H++SO42-;用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量;
(4)由(3)中分析可知溶液呈酸性,可加入无水碳酸钠或氢氧化钠固体,可以使溶液变为中性,故答案为:BD;
(5)环己酮在氯化钠中的溶解度较小,有利于环己酮分层;环己酮和水互不相溶,可用分液漏斗分离,所以选择的仪器为图3中的c,
故答案为:降低环己酮的溶解度,有利于环己酮分层;c;
(6)设NaClO溶液的浓度是x,
NaClO溶液中加入适量稀盐酸和KI固体(足量),发生的反应为:ClO-+2I-+2H+=Cl-+I2+H2O,
再用0.1000mol/L Na2S2O3标准溶液滴定,发生的反应为:I2+2Na2S2O3═2NaI+Na2S4O6,
则 ClO-~I2 ~2Na2S2O3
1 2
10×10-3×x×$\frac{25}{500}$ 0.1000×18×10-3
解得x=1.800mol/L,
故答案为:1.800mol/L.
点评 本题以环己酮制备为载体,考查化学实验基本操作、离子反应、关系式计算等,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案N2(g)+2O2(g)=2NO2(g)△H=+67.7KJ/mol
N2H4(g)+O2(g)=N2 (g)+2H2O(g)△H=-534KJ/mol
则1摩尔气体肼和NO2完全反应时放出的热量为( )
| A. | 100.3KJ | B. | 567.85KJ | C. | 500.15KJ | D. | 601.7KJ |
| A. | 将Fe(OH)3和水充分搅拌,滴加酚酞试液溶液变红色 | |
| B. | 在FeCl3溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | 在酸性FeSO4溶液中滴加KMnO4 溶液至反应完全,溶液呈无色 | |
| D. | 在FeCl3溶液中加入铜粉能溶解 |
| A. | 10℃,20ml,3mol/L的X溶液 | B. | 20℃,10ml,5mol/L的X溶液 | ||
| C. | 20℃,30ml,2mol/L的X溶液 | D. | 10℃,10ml,2mol/L的X溶液 |
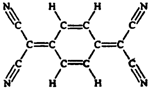 目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的是( )
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的是( )| A. | 该物质化学性质活泼,易氧化易加成 | |
| B. | 该分子不是平面分子,不可能所有原子共面 | |
| C. | 分子式为C12H4N4 | |
| D. | 该物质难溶于水 |
| A. | CuSO4 | B. | SiO2 | C. | NH4Cl | D. | Al |
| A. | H2O2溶液与酸性KMnO4溶液反应:2MnO4-+3H2O2+6H+═2Mn2++6H2O+4O2↑ | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2NO2-+8H++6I-═3I2+2NO↑+4H2O | |
| C. | 少量SO2通入碳酸钠溶液中:CO32-+SO2═CO2+SO32- | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO32-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
| A. | 缩小容器体积,使压强增大 | B. | 压强不变,充入N2 | ||
| C. | 体积不变,充入He使压强增大 | D. | 减小压强,使容器体积增大 |
