题目内容
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则2min内反应的平均速率VB=
0.2mol/(L?min)
0.2mol/(L?min)
,该反应的化学反应方程式为A+2B═3C
A+2B═3C
.分析:根据B的浓度的变化量和时间来计算利用B来表示的化学反应速率,利用反应速率之比等于化学计量数之比来书写反应的方程式.
解答:解:B的起始浓度均为1mol/L,反应进行2min后B的浓度为0.6mol/L,
则平均速率VB=
=0.2mol/(L?min),
同理平均速率VA=
=0.1mol/(L?min),
同理平均速率VC=
=0.3mol/(L?min),
根据化学反应速率之比等于化学计量数之比,
则A、B、C的化学计量数之比为0.1mol/(L?min):0.2mol/(L?min):0:3mol/(L?min)=1:2:3,
该反应的化学反应方程式为A+2B═3C,
故答案为:0.2mol/(L?min);A+2B═3C.
则平均速率VB=
| 1mol/L-0.6mol/L |
| 2min |
同理平均速率VA=
| 1mol/L-0.8mol/L |
| 2min |
同理平均速率VC=
| 0.6mol/L |
| 2min |
根据化学反应速率之比等于化学计量数之比,
则A、B、C的化学计量数之比为0.1mol/(L?min):0.2mol/(L?min):0:3mol/(L?min)=1:2:3,
该反应的化学反应方程式为A+2B═3C,
故答案为:0.2mol/(L?min);A+2B═3C.
点评:本题考查化学反应速率的计算,并利用反应速率之比等于化学计量数之比来确定反应方程式,难度不大,注重基础知识的考查和训练.

练习册系列答案
相关题目
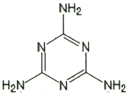

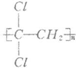 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由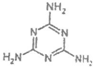

 ______.
______.