题目内容
【题目】按要求填空
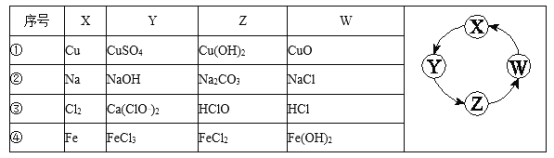
(1)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
写出对应的化学方程式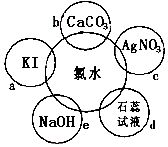
①b;
②c;
③e;
(2)能证明氯水具有漂白性的现象是;
(3)久置的氯水变为(填成份),用化学反应方程式表示为 .
(4)实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
填写字母2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
①请用双线桥标出该反应的电子转移方向和数目 .
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
【答案】
(1)2HCl+CaCO3=CaCl2+H2O+CO2↑;HCl+AgNO3=AgCl↓+HNO3;Cl2+2NaOH=NaCl+NaClO+H2O
(2)石蕊试液最终变为无色
(3)盐酸;2HClO ![]() 2HCl+O2↑
2HCl+O2↑
(4) ;高锰酸钾;1mol
;高锰酸钾;1mol
【解析】解:(1)①b发生盐酸与碳酸钙反应,反应的化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑,故答案为:2HCl+CaCO3=CaCl2+H2O+CO2↑;
②c是盐酸与硝酸银溶液反应,反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3 , 故答案为:HCl+AgNO3=AgCl↓+HNO3;
③氯气与氢氧化钠发生反应,生成氯化钠和次氯酸钠,反应的离子方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;(2)氯水中含有盐酸和次氯酸,盐酸能够使石蕊变红色,而次氯酸具有漂白性,能够是变红的石蕊褪色;故答案为:石蕊试液最终变为无色;(3)次氯酸不稳定受热分解生成氯化氢和氧气,化学方程式:2HClO ![]() 2HCl+O2↑,所以久置的氯水变为盐酸;故答案为:盐酸;2HClO
2HCl+O2↑,所以久置的氯水变为盐酸;故答案为:盐酸;2HClO ![]() 2HCl+O2↑;(4)①根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示:
2HCl+O2↑;(4)①根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示:  ,故答案为:
,故答案为:  ;②高锰酸钾是氧化剂,还原剂是浓盐酸,2mol高锰酸钾氧化剂消耗的16mol浓盐酸中,只有10mol浓盐酸做还原剂,所以氧化剂和被氧化的还原剂的量之间的关系为:2KMn04~10HCl,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量1mol,故答案为:高锰酸钾;1mol.
;②高锰酸钾是氧化剂,还原剂是浓盐酸,2mol高锰酸钾氧化剂消耗的16mol浓盐酸中,只有10mol浓盐酸做还原剂,所以氧化剂和被氧化的还原剂的量之间的关系为:2KMn04~10HCl,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量1mol,故答案为:高锰酸钾;1mol.
氯气溶于水,部分氯气与水反应生成盐酸和次氯酸,氯水中含有氯气、次氯酸分子,含有氢离子、次氯酸根离子、氯离子、少量氢氧根离子,次氯酸具有漂泊性,能够使有色布条褪色,次氯酸受热分解生成氯化氢和氧气,据此解答.