题目内容
(6分)2SO2(g)+O2(g)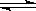 2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(1)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(3)保持同一反应温度,在相同的容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡 移动。(填“正向、不、逆向或无法确定是否)
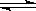 2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时(1)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(3)保持同一反应温度,在相同的容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡 移动。(填“正向、不、逆向或无法确定是否)
(1)98.3kJ(2)2<a≤3 (3)不(各2分)
考查可逆反应的有关计算。
(1)设消耗氧气的物质的量是x,则同时消耗SO2是2x,生成三氧化硫是2x,则3-2x+2-x+2x=(3mol+2mol)×0.9,解得x=0.5mol,所以达到平衡时,放出的热量为0.5mol×196.6kJ/mol=98.3kJ。
(2)根据(1)可知,平衡时三氧化硫的体积分数是2/9mol,所以要满足平衡时SO3的体积分数为2/9,则三氧化硫根据方程式转化为反应物后,SO2和氧气的物质的量分别应该都等于3mol和2mol,所以a的最大值是3mol。根据(1)可知,平衡时SO2的物质的量是2mol,所以要使起始时反应表现为向正反应方向进行,则a必须大于2mol,即a的取值范围是2<a≤3。
(3)设容器容积是1L,则根据(1)可知,平衡时平衡常数是 。由于此时
。由于此时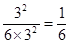 ,所以反应恰好是平衡状态,即平衡不移动。
,所以反应恰好是平衡状态,即平衡不移动。
(1)设消耗氧气的物质的量是x,则同时消耗SO2是2x,生成三氧化硫是2x,则3-2x+2-x+2x=(3mol+2mol)×0.9,解得x=0.5mol,所以达到平衡时,放出的热量为0.5mol×196.6kJ/mol=98.3kJ。
(2)根据(1)可知,平衡时三氧化硫的体积分数是2/9mol,所以要满足平衡时SO3的体积分数为2/9,则三氧化硫根据方程式转化为反应物后,SO2和氧气的物质的量分别应该都等于3mol和2mol,所以a的最大值是3mol。根据(1)可知,平衡时SO2的物质的量是2mol,所以要使起始时反应表现为向正反应方向进行,则a必须大于2mol,即a的取值范围是2<a≤3。
(3)设容器容积是1L,则根据(1)可知,平衡时平衡常数是
 。由于此时
。由于此时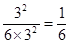 ,所以反应恰好是平衡状态,即平衡不移动。
,所以反应恰好是平衡状态,即平衡不移动。
练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
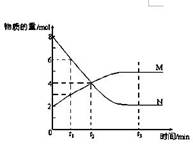
 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是 2NH3(g);△H<0
2NH3(g);△H<0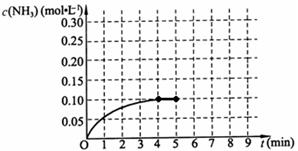
 3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题, 2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol?L-1, c(B2)=0.1mol?L-1,c(C)=1.6mol?L-1。若A2、B2、C的起始浓度分别为a mol?L-1、b mol?L-1、g mol?L-1请确定:
2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol?L-1, c(B2)=0.1mol?L-1,c(C)=1.6mol?L-1。若A2、B2、C的起始浓度分别为a mol?L-1、b mol?L-1、g mol?L-1请确定: 2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是 ?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小
?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小 ,混合气体的平均摩尔质量增大
,混合气体的平均摩尔质量增大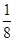 ,则方程式中a值是
,则方程式中a值是