题目内容
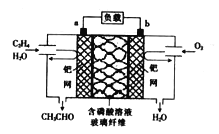
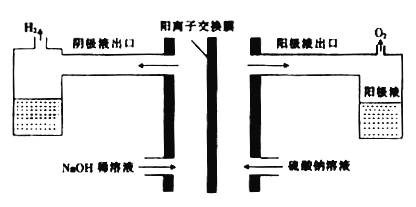
【题目】用硫酸处理红土镍矿时要消耗大量的硫酸,同时产生大量的硫酸钠及硫酸镁。为再生硫酸,科研人员利用电解食盐水的原理制取硫酸,装置如图。
(1)电解时,阳极的电极反应式为____________________,电解过程中阴极周围溶液的PH______(“增大”“减小”或“不变”)。
(2)硫酸镁销路不畅,而氢氧化镁较为畅销,获得氢氧化镁的方法是_____________________________。
(3)用电解原理也可处理含镍废水,同时还可回收金属镍,下图中①为__________(填“阴”或“阳”)离子交换膜。阴极上Ni2+放电时的电极反应式为______________________________。

【答案】 2H2O-4e-=4H++O2↑(或4OH- -4e-=2H2O+O2↑) 增大 将硫酸镁与阴极液反应制得氢氧化镁 阳 Ni2++2e-=Ni
【解析】(1)电解时,溶液中由水电离出来的氢氧根离子失电子产生氧气,则阳极的电极反应式为2H2O-4e-=4H++O2↑或4OH- -4e-=2H2O+O2↑,电解过程中阴极周围氢离子得电子产生氢气,氢氧根离子浓度增大,则溶液的PH增大;(2)硫酸镁销路不畅,而氢氧化镁较为畅销,获得氢氧化镁的方法是将硫酸镁与阴极液反应制得氢氧化镁;(3)该装置为电解池,图中右边池中废水中的氯离子进入中间区域,左边池中钠离子进行中间区域,故①应该为阳离子交换膜,阴极上Ni2+放电时生成镍单质析出在电极上,其电极反应式为:Ni2++2e-=Ni。

练习册系列答案
相关题目