题目内容
把a L含(NH4)2SO4和NH4NO3的混合液分为两等份:一份加入bmol 烧碱并加热,恰好把NH3全部赶出,另一份需含c molBaCl2溶液,使沉淀反应刚好完全,则NO3ˉ的浓度是
A.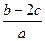 mol/L mol/L | B.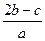 mol/L mol/L |
C.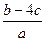 mol/L mol/L | D.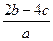 mol/L mol/L |
D
略

练习册系列答案
相关题目
题目内容
A.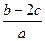 mol/L mol/L | B.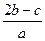 mol/L mol/L |
C.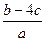 mol/L mol/L | D.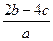 mol/L mol/L |
