题目内容
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10—3mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C.该温度下此反应的平衡常数K=144
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
B
解析试题分析:A、反应前2min的平均速率v(Z)=4.0×10—3mol/(L·min),错误;B、其他条件不变,降低温度,正逆反应速率都减慢,但是正向减小的程度小,在达到平衡前v(逆)<v(正),正确;C、该温度下此反应的平衡常数K=1.44,错误;D、该反应是一个前后分子数不变的反应,当达到平衡后再次加入生成物的量,平衡右移,但不能够消除这种改变,所以再次平衡时X的体积分数减小,错误。
考点:平衡常数的有关知识。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
一定质量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是
zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是
| A.平衡向正反应方向移动 | B.x+y<z |
| C.C的体积分数降低 | D.B的转化率增大 |
从下列实验事实所引出的相应结论正确的是 ( )
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | 物质的量浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
| D | 在容积可变的密闭容器中发生反应 H2(g)+I2(g)  2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 | 正反应速率加快,逆反应速率不变 |
向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:
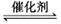
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态 |
| D.当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态 |
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g) Ni(CO)4(g) ΔH < 0
Ni(CO)4(g) ΔH < 0
反应二:Ni(CO)4(g) Ni(纯,s)+4CO(g) ΔH > 0
Ni(纯,s)+4CO(g) ΔH > 0
下列说法错误的是
| A.对于反应一,适当增大压强,有利于Ni(CO)4的生成 |
| B.提纯过程中,CO气体可循环使用 |
| C.升高温度,反应一的反应速率减小,反应二的速率增大 |
| D.对反应二,在180—200℃,温度越高,Ni(CO)4(g)的转化率越高 |
下列实验不能获得成功的是( )
| | 实验目的 | 实验步骤 |
| A. | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B. | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气) NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气) H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
| A.3.5mol/L | B.4.5mol/L | C.4mol/L | D.5mol/L |
 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求: