题目内容
 (2011?朝阳区一模)X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电子数是电子层数的3倍.下列说法中不正确的是( )
(2011?朝阳区一模)X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电子数是电子层数的3倍.下列说法中不正确的是( )分析:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素,结合元素所在周期表中的位置可知X为N元素,Z为S元素,W为Cl元素,结合元素周期律及物质的性质进行解答.
解答:解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素,结合元素所在周期表中的位置可知X为N元素,Z为S元素,W为Cl元素,
A、同主族自上而下元素的非金属性减弱,故非金属性Y>X,非金属性越强氢化物越稳定,则氢化物稳定性为Y>Z,故A正确;
B、非金属性W>Z,则最高价氧化物对应的水化物的酸性为W>Z,故B错误;
C、X为N元素,W为Cl元素,二者的气态氢化物相互反应生成NH4Cl,NH4Cl是离子化合物,含有离子键,铵根离子中含有共价键,故C正确;
D、电解水生成氢气与氧气,工业上电解饱和的氯化钠溶液生成氯气等,故D正确;
故选B.
A、同主族自上而下元素的非金属性减弱,故非金属性Y>X,非金属性越强氢化物越稳定,则氢化物稳定性为Y>Z,故A正确;
B、非金属性W>Z,则最高价氧化物对应的水化物的酸性为W>Z,故B错误;
C、X为N元素,W为Cl元素,二者的气态氢化物相互反应生成NH4Cl,NH4Cl是离子化合物,含有离子键,铵根离子中含有共价键,故C正确;
D、电解水生成氢气与氧气,工业上电解饱和的氯化钠溶液生成氯气等,故D正确;
故选B.
点评:本题考查位置结构性质关系,推断元素是解答本题的关键,注意整体掌握元素周期表,注意把握元素周期律的递变规律.

练习册系列答案
相关题目
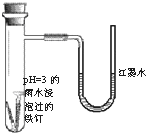 (2011?朝阳区一模)如图是探究铁发生腐蚀的装置图.发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
(2011?朝阳区一模)如图是探究铁发生腐蚀的装置图.发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )