题目内容
【题目】某小组同学在实验室设计实验模拟工业生产。
Ⅰ.用消石灰和氯化铵固体制备NH3

(1)NH3的发生装置应选择图中的__(填字母代号),制备NH3的化学方程式为__。
(2)欲收集一瓶干燥的NH3,选择图中的装置,其连接顺序为:发生装置→__(按气流方向,用小写字母表示)。
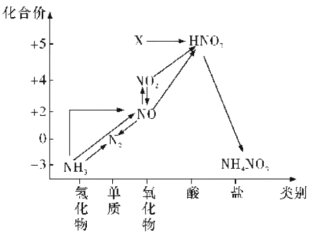
Ⅱ.设计了如图所示的实验装置模拟工业生产制备少量硝酸。

(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是__(填“吸热”或“放热”)反应,反应的化学方程式是__。
(4)B中试剂为__,NaOH溶液的作用是__。
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是__。
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(NO)的最佳比例为__。
【答案】A 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O c→d→f→e→i 放热 4NH3+5O2
CaCl2+2NH3↑+2H2O c→d→f→e→i 放热 4NH3+5O2![]() 4NO+6H2O 水 吸收尾气(NO、NO2) NH4NO3 1:2
4NO+6H2O 水 吸收尾气(NO、NO2) NH4NO3 1:2
【解析】
(1)用消石灰和氯化铵固体制备NH3 属于固固加热类型,发生装置应选择图中的A,制备NH3的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)欲收集一瓶干燥的NH3,需要用碱石灰干燥,选择图中的装置,其连接顺序为:发生装置→c→d→f→e→i
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是放热反应。反应的化学方程式是 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(4)B的作用是除去未反应的氨气所以选用水,NaOH溶液的作用是吸收尾气(NO、NO2)。
(5)①一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,氨气和硝酸能反应生成硝酸铵,化学方程式:2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,NH3+HNO3=NH4NO3,故答案为:NH4NO3
②由4NH3+5O2![]() 4NO+6H2O、4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,则原料氨气和氧气物质的量的投料比为1:2。
4NO+6H2O、4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,则原料氨气和氧气物质的量的投料比为1:2。

【题目】下表是元素周期表的一部分,请用化学符号回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___。
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是___,最高价氧化物的水化物中酸性最强的是___。
(3)第三周期元素形成的简单离子中半径最小的微粒是___,写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式___、___。
(4)元素③的氢化物的电子式是___;该氢化物与元素⑩的氢化物发生反应的化学方程式___。
(5)用电子式分别写出元素⑨与元素②、⑥形成化合物过程___、___。