题目内容
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景。某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)

已知信息:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃。与碱反应和氯气相似。
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
(1)制备ClO2的化学方程式:2KClO3+H2C2O4= 2KHCO3+2ClO2↑;下列说法正确的是
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中失去电子
D.1mol KClO3参加反应有2mol电子转移
(2)A装置中还缺少的一样仪器名称是__________,
若将A中烧杯去掉,让烧瓶直接加热是否可以,为什么?_________________________。
(3)C装置吸收尾气后,溶液中含有NaOH、Na2CO3等溶质,该同学认为C中还可能含有NaClO2、NaClO3,试分析可能的原因,并写出有关化学方程式 ________ 。
(4)实验室还可通过以下反应制得ClO2:
KClO3+ H2C2O4+ H2SO4= ClO2↑+ K2SO4+ CO2↑+ H2O.
配平上述方程式。0.5 mol KClO3参加反应有 个电子转移。
(1)AC (2)温度计;不可以,若直接加热温度难以控制。(3)ClO2挥发,进入C中,与氢氧化钠溶液反应。2ClO2+2NaOH= NaClO2 +NaClO3+H2O
(4)2KClO3+H2C2O4+H2SO4= 2ClO2↑+K2 SO4+2CO2↑+2H2O3.01×1023 (或0.5NA)
【解析】
试题分析:(1)反应2KClO3+H2C2O4= 2KHCO3+2ClO2↑中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,A、KClO3中Cl元素的化合价由+5价降低为+4价,则在反应中得到电子,正确;B、KClO3中Cl元素的化合价由+5价降低为+4价,被还原生成ClO2,ClO2为还原产物,错误;C、H2C2O4中C元素的化合价由+3价升高到+4价,草酸为还原剂,正确;D、1molKClO3参加反应转移电子为1mol,错误。(2)制备ClO2气体的反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,必须控制温度在60℃,采用水浴加热,应用温度计则水温;(3)由信息①知ClO2的沸点11.0℃,易挥发,与碱反应和氯气相似可得:2ClO2+2NaOH= NaClO2 +NaClO3+H2O(4)利用化合价升降法配平氧化还原方程式;KClO3中Cl元素的化合价由+5价降低为+4价,1mol KClO3参加反应转移电子为1mol,0.5 mol KClO3参加反应有0.5NA个电子转移。
考点:考查氧化还原反应基本概念,化学方程式的书写及有关实验。

 学习实践园地系列答案
学习实践园地系列答案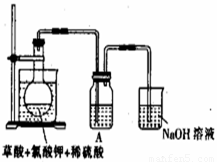
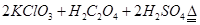
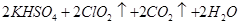
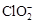 )。饮用水中ClO2、
)。饮用水中ClO2、
 ,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
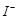 将溶液中的
将溶液中的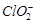 还原为
还原为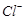 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为: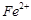 将
将


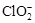 )。饮用水中ClO2、
)。饮用水中ClO2、
 ,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为
,滴定达到终点时溶液的颜色变化为
 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为: 将
将 ②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。