题目内容
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
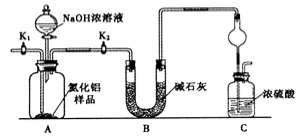
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:
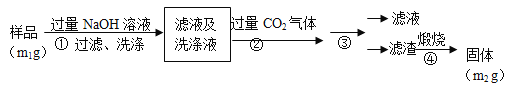
(4)步骤②生成沉淀的离子方程式为_________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
【答案】(1)防止倒吸(2)关闭K1,打开K2; 把装置中残留的氨气全部赶入C装置
(3)C装置出口处连接一个干燥装置
(4)CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓
(5)过滤、洗涤 ![]()
【解析】
试题分析:(1)用浓硫酸吸收氨气时,极易发生倒吸,因此C装置中球形干燥管的作用是防止倒吸;(2)组装好实验装置,首先检查装置的气密性,再加入实验药品,然后关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的把装置中残留的氨气全部赶入C装置。(3)由于浓硫酸不仅可以吸收氨气,还可以吸收空气中的水蒸汽,因此会导致测定结果偏高,可以在C装置出口处连接一个干燥装置进行改进;(4)步骤②是NaAlO2与CO2发生复分解反应,生成Al(OH)3沉淀,故反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;(5)步骤③的操作是过滤并洗涤;根据Al原子守恒计算AlN的纯度。最后经煅烧得到的固体是Al2O3,其质量为m2,则Al原子的物质的量为:![]() ,因此样品中AlN的质量为:
,因此样品中AlN的质量为:![]() ,故AlN的纯度为
,故AlN的纯度为![]() 。
。

【题目】
(1)根据计算用托盘天平需称取氯化钠_________ g;
(2)配制溶液时,除需要烧杯、玻璃棒外,还必须用到的玻璃仪器有 ;
(3)配制溶液有下列几步操作:a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容.正确的操作顺序是 ;
(4)下列操作结果使溶液物质的量浓度偏低的是___ ______ ;
A.没有将洗涤液转入容量瓶中 |
B.加水定容时,水的量超过了刻度线 |
C.定容时,俯视容量瓶的刻度线 |
D.容量瓶洗涤后,未经干燥处理 |
(5)取出该NaCl溶液10mL加水稀释到200mL,稀释后溶液中NaCl的物质的量浓度是_________