题目内容
【题目】由金属Na、Cu、C、N、B等元素组成的物质在生活和工业上有着广泛用途。
(1)基态Cu+的外围电子轨道式为_______。
(2)H3BNH3是储氢材料,其制备原理为:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,其中(HB=NH)3是一种六元环状化合物。化合物H3BNH3中B原子的杂化方式为_______;1个(HB=NH)3分子中含有 ___个σ键。
(3) B、C、N、O原子的第一电离能由大到小的顺序为_____________________。
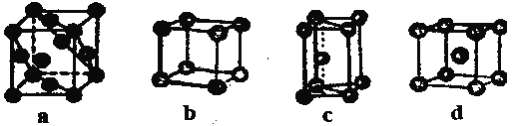
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为____(填字母)。
(5)已知NaCl的摩尔质量为Mg·mol-1,密度为pg·㎝-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为____________。
【答案】 ![]() sp3 12 N>O>C>B d
sp3 12 N>O>C>B d ![]()
【解析】(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10,外围电子轨道式为![]() ,故答案为:
,故答案为: ![]() ;
;
(2)化合物H3BNH3中B原子与3个H原子和一个N原子相连接,价层电子对数=4,杂化方式为sp3;1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键.B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个,故答案为:sp3;12;
(3) B、C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C>B,故答案为:N>O>C>B;
(4)金属钠为体心立方结构,故选d;
(5)设晶胞边长为a,在NaCl晶胞中,含Cl-4个;含Na4个,根据密度公式ρ=![]() ,可得a=
,可得a=![]() ,所以晶胞面对角线长为
,所以晶胞面对角线长为![]() ×
×![]() ,而两个距离最近的氯离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的氯离子中心间的距离为
,而两个距离最近的氯离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的氯离子中心间的距离为![]() ×
×![]() ,故答案为:
,故答案为:![]() ×
×![]() 。
。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
