题目内容
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下: 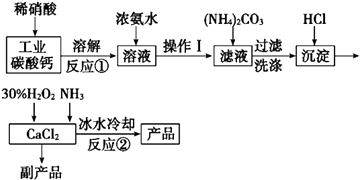
已知:CaO28H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.
(1)写出反应①中氧化还原反应的离子方程式: .
(2)向反应①后的溶液中加浓氨水的目的是: , (用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):①;② .
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.已知:I2+2S2O32﹣═2I﹣+S4O62﹣ .
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”“偏低”或“偏高”),原因是 .
【答案】
(1)3FeCO3+10H++NO3﹣=3Fe3++NO↑+3CO2↑+5H2O
(2)Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
(3)防止H2O2分解,提高其利用率;降低CaO2?8H2O溶解度,提高产率
(4)偏高;在酸性条件下空气中的O2也可以把KI氧化为I2 , 使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高
【解析】解:碳酸钙、碳酸镁与稀硝酸反应生成硝硝酸钙、硝酸镁与二氧化碳,碳酸亚铁与稀硝酸反应生成硝酸铁、二氧化碳、NO,溶液中加入浓氨水,镁离子、铁离子转化为氢氧化镁、氢氧化铁沉淀,过滤除去,滤液中加入碳酸铵将硝酸钙转化为碳酸钙,过滤分离得到碳酸钙,再与盐酸反应生成氯化钙,在加入过氧化氢、氨气得到反应得到CaO2 , 溶液冷却结晶得到CaO28H2O,副产品中含有氯化铵,(1)反应①中只有FeCO3与硝酸反应是氧化还原反应生成硝酸铁、一氧化氮、二氧化碳和水,反应方程式为:3FeCO3+10H++NO3﹣=3Fe3++NO↑+3CO2↑+5H2O,
所以答案是:3FeCO3+10H++NO3﹣=3Fe3++NO↑+3CO2↑+5H2O;(2)加入氨水使Mg2+、Fe3+沉淀完全,反应的离子方程式为:Mg2++2NH3H2O=Mg(OH)2↓+2NH4+ , Fe3++3NH3H2O=Fe(OH)3↓+3NH4+ ,
所以答案是:Mg2++2NH3H2O=Mg(OH)2↓+2NH4+ , Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;(3)H2O2受热易分解,采用冰水控制温度在0℃左右,防止其分解,提高利用率,同时温度低能降低CaO28H2O溶解度,提高产率,
所以答案是:防止H2O2分解,提高其利用率;降低CaO28H2O溶解度,提高产率;(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能偏高,因为在酸性条件下空气中的O2也可以把KI氧化为I2 , 使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高;
所以答案是:偏高;在酸性条件下空气中的O2也可以把KI氧化为I2 , 使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高.

 备战中考寒假系列答案
备战中考寒假系列答案