��Ŀ����
����Ŀ����һ���������ܱ������м���2mol A��0.6molC��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯��ͼһ��ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������֪t3-t4��Ϊʹ�ô�����ͼһ��t0-t1��c(B)δ������

��1����t1=15min����t0-t1����CŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊv(C)=___________��
��2��t4-t5�θı������Ϊ____________��B����ʼ���ʵ���Ϊ____________������ƽ��ʱ��Ӧ��ƽ�ⳣ�����±���ʾ��
t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
K1 | K2 | K3 | K4 | K5 |
K1��K2��K3��K4��K5֮��Ĺ�ϵΪ____________(����>������<������=������)��
��3��t5-t6�α����������¶Ȳ��䣬��A�����ʵ������仯��0.01mol�����˹����������������Ƚ�������ΪakJ��д�����¶��¸÷�Ӧ���Ȼ�ѧ����ʽ____________��
���𰸡���1��0.02mol/(L��min)��
��2����Сѹǿ��1.0mol��K1=K2=K3=K4<K5��
��3��2A(g)+B(g) ![]() 3C(g) ��H=+200akJ/mol��
3C(g) ��H=+200akJ/mol��
��������
�����������1��15min�ڣ���CŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊv(C)=![]() =0.02 mol/(Lmin)���ʴ�Ϊ��0.02 mol/(Lmin)��
=0.02 mol/(Lmin)���ʴ�Ϊ��0.02 mol/(Lmin)��
��2��t3��t4��t4��t5������ƽ���Dz��ƶ��ģ���ֻ����ѹǿ�ʹ���Ӱ��ģ����Ӧ���ƶϸ÷�ӦΪ������仯�ķ�Ӧ��t3��t4��ƽ���ԭƽ�������Ҫ�죬��t4��t5�������ֱ�������ǰ��Ӧ�ǼӴ�������Ϊ����ֻ����һ�Σ�t4��t5��Ϊ��ѹ����Ӧ���Ũ�Ƚ��ͣ��������Ũ�������ͼһ��֪��AΪ��Ӧ�CΪ�����A�ı仯Ϊ0.2mol/L��C�ı仯��Ϊ0.3mol/L�������ڸ÷�ӦΪ������仯�ķ�Ӧ������BΪ��Ӧ����ݻ�ѧ��Ӧ������֮�ȵ��ڻ�ѧ����ʽǰ�ļ���ϵ���ȣ��÷�Ӧ�ķ���ʽΪ2A(g)+B(g) ![]() 3C(g)�����ԣ���c(B)=
3C(g)�����ԣ���c(B)=![]() ��n(A)=
��n(A)=![]() ��0.2mol/L=0.1mol/L����ʼ2molA����Ӧ��Ũ��Ϊ1mol/L�������Ӧ��
��0.2mol/L=0.1mol/L����ʼ2molA����Ӧ��Ũ��Ϊ1mol/L�������Ӧ��![]() =2L����B����ʼ���ʵ���Ϊn(B)=(0.1mol/L+0.4mol/L)��2L=1mol��t1-t2�Σ�����ƽ��״̬��c(A)ƽ��=0.8mol/L��c(B)ƽ��=0.4mol/L��c(C)ƽ��=0.6mol/L��K1=
=2L����B����ʼ���ʵ���Ϊn(B)=(0.1mol/L+0.4mol/L)��2L=1mol��t1-t2�Σ�����ƽ��״̬��c(A)ƽ��=0.8mol/L��c(B)ƽ��=0.4mol/L��c(C)ƽ��=0.6mol/L��K1=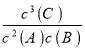 =
=![]() =0.84��t2-t3�Σ�Ϊ�ı�Ũ�ȣ�ƽ���ƶ���ƽ�ⳣ�����䣬K2=0.84��t3-t4�Σ�ʹ�ô������ӿ췴Ӧ��ƽ�ⳣ�����䣬K3=0.84��t4-t5�Σ�Ϊ����ѹǿ����Ӧ���ʽ��ͣ�ƽ�ⲻ�ƶ���ƽ�ⳣ�����䣬K4=0.84��t5-t6�Σ�Ϊ�����¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������ K1=K2=K3=K4��K5���ʴ�Ϊ����Сѹǿ��1.0mol��K1=K2=K3=K4��K5��
=0.84��t2-t3�Σ�Ϊ�ı�Ũ�ȣ�ƽ���ƶ���ƽ�ⳣ�����䣬K2=0.84��t3-t4�Σ�ʹ�ô������ӿ췴Ӧ��ƽ�ⳣ�����䣬K3=0.84��t4-t5�Σ�Ϊ����ѹǿ����Ӧ���ʽ��ͣ�ƽ�ⲻ�ƶ���ƽ�ⳣ�����䣬K4=0.84��t5-t6�Σ�Ϊ�����¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������ K1=K2=K3=K4��K5���ʴ�Ϊ����Сѹǿ��1.0mol��K1=K2=K3=K4��K5��
��3�����ݷ���ʽ���㣬��A�����ʵ������仯��0.01mol�����˹����������������Ƚ�������Ϊa kJ����Ӧ2molAʱ����������200akJ������ͼ���֪��t5��t6��ӦΪ�����¶ȣ�����Ӧ���ʴ����淴Ӧ���ʣ�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ�������Ȼ�ѧ����ʽΪ2A(g)+B(g) ![]() 3C(g)��H=+200a kJ/mol���ʴ�Ϊ��2A(g)+B(g)
3C(g)��H=+200a kJ/mol���ʴ�Ϊ��2A(g)+B(g) ![]() 3C(g)��H=+200a kJ/mol��
3C(g)��H=+200a kJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�