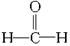题目内容
某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。已知:①NO+NO2+2OH-====2![]() +H2O;②气体液化温度:NO2:21 ℃、NO:-152 ℃
+H2O;②气体液化温度:NO2:21 ℃、NO:-152 ℃
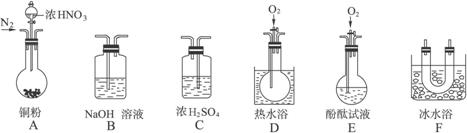
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”):
甲:_______________;乙:_______________;丙:_______________。
具体说明不能验证的主要原因(能验证的方案,不必回答原因):
甲方案:______________________________________________________________________。
乙方案:______________________________________________________________________。
丙方案:______________________________________________________________________。
(2)实验开始时首先通入足量的N2,其目的是____________________________________。
(3)确认气体中含NO的现象是_________________________________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是______________________________。
(1)甲:能 乙:不能 丙:不能
乙方案:混合气体在通过B时,因发生反应:NO+NO2+2NaOH====2NaNO2+H2O使NO消耗,后续实验无法验证是否有NO
丙方案:混合气体通过F时,NO2与H2O蒸气发生反应:3NO2+H2O====2HNO3+NO,使部分NO2转化为NO,产生干扰,从而不能确认Cu和浓HNO3反应是否有NO生成
(2)排尽整个装置中的空气,防止产生的NO被氧化生成NO2
(3)D装置中通入O2后有红棕色气体产生
(4)4NO2+O2+4OH-====4![]() +2H2O
+2H2O
解析:
此题综合考查了氮及其化合物知识。铜与浓硝酸反应生成二氧化氮,浓度小时生成一氧化氮,要验证一氧化氮,应排除二氧化氮的干扰,即防止二氧化氮与水反应生成NO,因此需先干燥。又因二氧化氮的沸点较高,可通过降温使之液化,这样剩余NO气体与通入的氧气反应出现红棕色,即证明有NO生成。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案(14分)某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是氯气能与水作用形成具有________性的次氯酸,相关反应的离子方程式为________________________;
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0 mg/L 之间时,效果最好。上图是该小组测定的每天19∶00时游泳池中水的含氯量,有哪几天使用游泳池不卫生_________________:
(3)你认为哪几天的天气炎热、阳光强烈________,说出一种理由是____________ ____________;
(4)在对游泳池水中通入氯气消毒时,当发生氯气泄漏,应立即关闭氯气罐,还应采取下列自救方法________。(选填序号)
| A.用湿润的毛巾捂住口鼻跑向低处 |
| B.用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处 |
| C.用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处 |
| D.用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处 |

 (2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
(2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究: