题目内容
中学化学中常见的某反应的化学方程式为a+b→c+d+H2O(未配平,反应条件略去).请回答下列问题:
(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为______.
(2)若c、d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通人溴水中,橙色褪去,写出其褪色过程的离子方程式为______.
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,若在标准状况下收集c气体进行喷泉实验,实验完成后所得溶液的物质的量浓度为______mol/L.
(4)当d为氯碱工业的主要原料,c是造成温室效应的主要气体之一,则上述反应的化学方程式为______.
解:(1)(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中,则Fe与硝酸反应生成硝酸铁、NO和水,发生的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O;
(2)若c、d为气体,且都能使澄清石灰水变浑浊,则c、d分别为二氧化碳、二氧化硫,将此混合气体通人溴水中橙色褪去,发生溴与二氧化硫的氧化还原反应生成硫酸和HBr,
发生的离子反应为SO2+Br2+2H2O═4H++SO42-+2Br-,故答案为:SO2+Br2+2H2O═4H++SO42-+2Br-;
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,则c为氨气,设喷泉实验中的烧瓶容积为VL,喷泉实验后溶液的体积为VL,则浓度为 =
=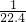 mol/L=0.045mol/L,故答案为:
mol/L=0.045mol/L,故答案为: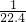 或0.045;
或0.045;
(4)当d为氯碱工业的主要原料,c是造成温室效应的主要气体之一,则d为NaCl,c为二氧化碳,所以该反应为盐酸与碳酸钠的反应或盐酸与碳酸氢钠的反应,则上述反应为
Na2CO3+2HCl═2NaCl+CO2↑+H2O或NaHCO3+HCl═NaCl+CO2↑+H2O,
故答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O或NaHCO3+HCl═NaCl+CO2↑+H2O.
分析:(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中,则Fe与硝酸反应生成硝酸铁、NO和水;
(2)若c、d为气体,且都能使澄清石灰水变浑浊,则c、d分别为二氧化碳、二氧化硫,将此混合气体通人溴水中橙色褪去,发生溴与二氧化硫的氧化还原反应生成硫酸和HBr;
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,则c为氨气,利用浓度、物质的量、溶液的体积的关系来计算;
(4)当d为氯碱工业的主要原料,c是造成温室效应的主要气体之一,则d为NaCl,c为二氧化碳,所以该反应为盐酸与碳酸钠的反应或盐酸与碳酸氢钠的反应.
点评:本题考查离子反应方程式的书写,熟悉发生的反应即可解答,注意题目中的信息和所学知识的结合来判断物质及浓度的计算等来解答,题目难度不大.
故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O;
(2)若c、d为气体,且都能使澄清石灰水变浑浊,则c、d分别为二氧化碳、二氧化硫,将此混合气体通人溴水中橙色褪去,发生溴与二氧化硫的氧化还原反应生成硫酸和HBr,
发生的离子反应为SO2+Br2+2H2O═4H++SO42-+2Br-,故答案为:SO2+Br2+2H2O═4H++SO42-+2Br-;
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,则c为氨气,设喷泉实验中的烧瓶容积为VL,喷泉实验后溶液的体积为VL,则浓度为
 =
=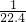 mol/L=0.045mol/L,故答案为:
mol/L=0.045mol/L,故答案为: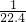 或0.045;
或0.045;(4)当d为氯碱工业的主要原料,c是造成温室效应的主要气体之一,则d为NaCl,c为二氧化碳,所以该反应为盐酸与碳酸钠的反应或盐酸与碳酸氢钠的反应,则上述反应为
Na2CO3+2HCl═2NaCl+CO2↑+H2O或NaHCO3+HCl═NaCl+CO2↑+H2O,
故答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O或NaHCO3+HCl═NaCl+CO2↑+H2O.
分析:(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中,则Fe与硝酸反应生成硝酸铁、NO和水;
(2)若c、d为气体,且都能使澄清石灰水变浑浊,则c、d分别为二氧化碳、二氧化硫,将此混合气体通人溴水中橙色褪去,发生溴与二氧化硫的氧化还原反应生成硫酸和HBr;
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,则c为氨气,利用浓度、物质的量、溶液的体积的关系来计算;
(4)当d为氯碱工业的主要原料,c是造成温室效应的主要气体之一,则d为NaCl,c为二氧化碳,所以该反应为盐酸与碳酸钠的反应或盐酸与碳酸氢钠的反应.
点评:本题考查离子反应方程式的书写,熟悉发生的反应即可解答,注意题目中的信息和所学知识的结合来判断物质及浓度的计算等来解答,题目难度不大.

练习册系列答案
相关题目