题目内容
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,22.4 L H2O含有的分子数为NA |
| B.500mL 1moL/L的盐酸溶液中含有的HCl分子数为0.5 NA |
| C.通常状况下, NA个CO2分子占有的体积约为22.4L |
| D.23gNa与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA |
D
解析试题分析:A、标准状况下水不是气态,不能适用于气体摩尔体积,因此标准状况下,22.4 L H2O含有的分子数一定不是NA,A不正确;B、氯化氢是电解质溶于水完全电离出氢离子和氯离子,即盐酸溶液中不存在氯化氢分子,B不正确;C、NA个CO2分子的物质的量是1mol,但在通常状况下其体积不是22.4L,C不正确;D、23g钠的物质的量=23g÷23g/mol=1mol,钠是活泼的金属在反应中只能失去1个电子,所以23gNa与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA,D正确,答案选D。
考点:考查阿伏伽德罗常数的计算

练习册系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.含0.1 mol BaCl2的溶液中Cl-数为0.1NA | B.22 g CO2所含有的分子数为0.5NA |
| C.11.2 L CO2所含有的分子数为0.5NA | D.常温下NA个Cl2分子所占有的体积为22.4 L |
甲、乙两烧杯中各盛放有100mL 2mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,充分反应结束后测得生成的气体体积比为甲:乙=2:3,则加入铝粉的质量为 ( )
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
相同质量的SO2和SO3它们之间的关系正确的是( )
| A.所含硫原子的物质的量之比为1:1 | B.氧原子的物质的量之比为5:6 |
| C.氧元素的质量比为2:3 | D.硫元素的质量比为5:4 |
实验室里需要480 mL 0.1mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是[胆矾(CuSO4·5H2O)]
| A.称取7.68 g硫酸铜,加入500 mL水 |
| B.称取12.0 g胆矾配成500 mL溶液 |
| C.称取8.0 g硫酸铜,加入500 mL水 |
| D.称取12.5 g胆矾配成500 mL溶液 |
化学用语是学习化学的重要工具。下列化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O 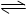 HCO3-+OH- HCO3-+OH- |
B.FeCl3水解的离子方程式:Fe3++3H2O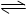 Fe (OH)3+3H+ Fe (OH)3+3H+ |
| C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1 |
| D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g)△H = 110.5kJ·mol-1 |
下列各组物质中,分子数目相同的是
| A.2g H2和16gO2 |
| B.1 mol O2和18gH2O |
| C.22.4 L He和1mol H2 |
| D.标准状况下,2 L H2和2 L H2O |
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5 mol·L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为
| A.0.05mol | B.0.1mol |
| C.0.2mol | D.0.25mol |
下列叙述中错误的是
| A.相同体积的任何气体都含有相同数目的原子 |
| B.标准状况下,5L H2S气体与5L NH3的原子个数比为3∶4 |
| C.同温同压下相同体积的N2气和CO气体有相同物质的量和相同的质量 |
| D.当粒子数相同时,气体的体积主要决定于气体粒子之间的距离 |