题目内容
5.根据元素周期律,下列判断不正确的是( )| A. | 金属性:Na>Mg>Al | B. | 非金属性:F>Cl>Br | ||
| C. | 氢化物稳定性:HBr>HCl>HF | D. | 元素的最高化合价:Cl>S>P |
分析 A.同一周期,随着原子序数增大,金属性减弱;B.同一主族元素,元素非金属性随着原子序数增大而减弱;C.元素的非金属性越强,其氢化物的稳定性越强;D.主族元素的最高化合价与其所在族序数相同.
解答 解:A.同一周期,随着原子序数增大,金属性减弱,故金属性Na>Mg>Al,故A正确;B.同一主族元素,元素非金属性随着原子序数增大而减弱,所以非金属性F>Cl>Br,故B正确;C.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>Br,所以氢化物的稳定性HF>HCl>HBr,故C错误;D.Cl、S和P分别处于VIIA、VIA和VA,故最高化合价分别为+7、+6和+5,故D正确,故选C.
点评 本题考查元素周期律,明确同一周期元素原子结构及其元素周期律是解本题关键,知道非金属性强弱判断方法,知道非金属性强弱与其单质的氧化性、氢化物的稳定性、最高价含氧酸酸性强弱关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.在体积固定不变的密闭容器中,充入2molNO和1molO2,在一定条件下达到平衡时,NO的转化率为95%,此时容器内的压强与开始时的压强之比是( )
| A. | 等于$\frac{2.05}{3}$ | B. | 小于$\frac{2.05}{3}$ | C. | 大于$\frac{2.05}{3}$ | D. | 等于$\frac{2}{3}$ |
13.在由水电离产生的c(H+)=1×10-14mol•L-1的溶液中,一定可以大量共存离子组是( )
| A. | NH4+、Al3+、Br-、SO42- | B. | Na+、Mg2+、Cl-、NO3- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | K+、Na+、SO42-、SO32- |
10.下列化合物即含极性键又含非极性键的极性分子的是( )
| A. | C2H4 | B. | CH4 | C. | H2O2 | D. | CO2 |
14.下列气体无色且有毒的是( )
| A. | H2 | B. | NO | C. | O2 | D. | Cl2 |
15.实验室中,下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(硝基苯):加少量蒸馏水振荡,待分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | NH3(水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 乙烷(乙烯):通入氢气发生加成反应 |
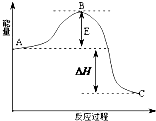 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题: 与
与 ,③金刚石与石墨,④乙醇(CH3-CH2-OH)与二甲醚(CH3OCH3).
,③金刚石与石墨,④乙醇(CH3-CH2-OH)与二甲醚(CH3OCH3).